1. 서 론
2. 재료 및 방법
2.1 공시균주
2.2 공시재료
2.3 실험방법
3. 결과 및 고찰
3.1 미생물 생장조건에 따른 최적 배양 조건 평가
3.2 미생물 생장에 따른 환원당 생산 효율
3.3 미생물 전처리에 따른 α-셀룰로오스 특성 변화
4. 결 론
1. 서 론
재생가능하고 지속적으로 소재를 사용하기 위해 생분해성, 비석유 기반, 환경에 안전한 원료 사용의 필요성이 커지고 있다. 셀룰로오스 기반 천연 소재는 임산물, 소재, 직물, 포장재 등의 산업에서 활발하게 사용되고 있으며, 생분해성, 인체 안전성, 풍부한 천연자원으로 활용 빈도가 점차 커지고 있다.1) 셀룰로오스는 결정(crystalline) 및 비결정 영역(amorphous region)으로 이루어져 있다. 셀룰로오스에서 결정 영역과 비결정 영역을 함께 추출하여 기계적으로 처리한 경우, 셀룰로오스 나노섬유(cellulose nanofibers, CNF)라고 하며, 강한 산 처리를 통해 비결정 영역이 제거되었을 때, 셀룰로오스 나노크리스탈(cellulose nanocrystal, CNC)이라고 한다. 셀룰로오스를 나노 크기로 조절하면 인장강도, 탄성률, 열 저항성 등의 물리적 특성이 향상된다.2)
셀룰로오스를 나노 크기로 만들기 위해 기계(고압호모게나이저, 볼밀, 디스크 밀 등), 화학(황산, 염산, TEMPO 산화 등) 및 생물학(효소)적 방법을 통해 CNF 및 CNC가 제조될 수 있다. 그러나 기계적 처리는 제조 시 소모되는 에너지가 크고, 장비의 구입 및 유지비용이 높다. 화학적 방법은 농도가 높은 산(Acid)을 사용할 경우, 취급 시 환경 및 인체에 위험성이 높고, 가수분해에 의해 수율이 감소될 수 있다.
현재 화학적(NaOH, KOH, TEMPO 산화) 전처리 이후 간단한 기계적(그라인더, 고압 호모게나이저, 고강도 초음파 등) 처리로 CNF 및 CNC를 제조할 수 있는 연구들이 진행되고 있다. 효소 전처리의 경우 연속 반응성, 약 50℃의 온화한 반응 조건, 대량의 화학약품 불필요 등 친환경 전처리 기술로서 주목받고 있다. 하지만 셀룰로오스를 효과적으로 산화가수분해 할 수 있는 효소의 구입이 어렵고, 가격이 매우 높다는 단점이 있다. 또한 셀룰로오스를 분해할 수 있는 미생물 확보, 효소 당화를 통한 바이오에너지 등의 제한적인 연구로 인해 활발하게 이용되고 있지 못하는 실정이다.
자연계에는 셀룰로오스를 분해하는 cellulase 생산 미생물이 풍부하게 존재한다.3) 이러한 미생물은 셀룰로오스를 분해하여 자원 순환에 중대한 역할을 하는 것으로 알려져 있다. 미생물 유래 셀룰로오스 분해는 endo-β-1,4-cellulase (EC 3.2.1.4)에 의한 분해과정을 통해 셀룰로오스에서 생성된 환원/비환원 말단에 exo-β-1, 4-cellulase(EC 3.2.1.91)가 작용하여 cellobiose가 생성되고, 최종적으로 β-1,4-glucosidase(EC 3.2.1.21)에 의해 cellobiose가 glucose로 분해되는 과정을 거쳐 사용된다. 특히 많은 Bacillus spp.는 세포외로 풍부한 효소를 분비하여 셀룰로오스를 분해할 수 있다.4) 대표적으로 Bacillus subtilis, Bacillus licheniformis5), Bacillus coagulans6), Bacillus amyloliquefaciens7), Bacillus cereus8) 등이 있다. 이러한 셀룰로오스 분해효소의 활용성 증가는 많은 생물소재 전환 기술에 중요한 부분으로 작용되고 있다.
본 연구는 셀룰로오스 분해효소를 생성하는 미생물 2종을 선정하고, 미생물이 셀룰로오스 분해에 미치는 영향을 평가하고자 하였다. 이에 따라 셀룰로오스 분해효소 미생물의 최적 배양조건, 환원당 생성 효율, 미생물 전처리 및 볼밀 처리를 통한 셀룰로오스 특성 변화를 검토하고자 하였다.
2. 재료 및 방법
2.1 공시균주
Cellulase 효소가 생성되는 미생물로 Bacillus subtilis (KCCM-32835)와 Bacillus licheniformis(KCTC-1026)을 선정하였다. 선정된 미생물은 nutrient agar(BD Difco, USA) 배지를 이용하여 3회 계대배양을 실시하고, 이후 nutrient broth(BD Difco, USA) 배지에 배양시켜 사용하였다.
2.2 공시재료
미생물 생장 최적조건을 확보하기 위해 CMC 배지 [sodium carboxymethyl cellulose(CMC, Mw: ~700,000, Sigma- Aldrich, USA) 10 g/L, yeast extract(BD Difco, USA) 5 g/L, peptone(BD Difco, USA) 5 g/L, K2HPO4 (99%, Daejung, Korea) 1 g/L, MgSO4·7H2O(98%, Sigma-Aldrich, USA) 0.2 g/L, NaCl(99%, Sigma- Aldrich, USA) 1 g/L]를 배지로 제조하였다. 미생물 처리에 따른 환원당 생산 능력을 확인하기 위하여 3,5- dinitrosalicylic acid(98%, Sigma-Aldrich, USA)와 potassium sodium tartrate tetrahydrate(99%, Sigma- Aldrich, USA)을 이용하여 환원당을 정량하였다. 미생물 전처리 후 미생물을 제거하기 위해 lysozyme(Thermo Scientific, USA)을 활용하였다.
2.3 실험방법
2.3.1 미생물 생장 및 환원당 생산 조건 평가
CMC 배지 250 mL 삼각플라스크에 pH 5, 6, 7, 8로 조절된 배양액 100 mL 넣고 B. subtilis와 B. licheniformis를 각각 1 mL씩 접종(OD 600 = 0.1)하였다. 회전식 배양기에서 rpm(100, 150), pH(5, 6, 7, 8), 배양온도(25, 30, 35℃)를 다르게 설정하여 반응시켰다. 총 96시간까지 배양하였으며 3, 6, 9, 12, 24, 48, 72, 96시간마다 1 mL씩 취하여 UV-spectrophotometer(Optizen 2120 UV plus, Mecasys, Korea)로 600 nm 파장에서 미생물 생장을 측정하였다.
환원당은 반응시간에 따라 1 mL씩 시료를 회수하고, 이후 원심분리기(Smart 15, Hanil, Korea)를 이용하여 10,000 rpm, 10분 동안 원심분리를 실시하였다. 원심분리된 배양액 0.3 mL를 제조된 DNS 시약 0.9 mL와 혼합하여, 100℃, 5분 동안 반응시켰다. 이후 얼음물에 5분간 담궈 반응을 종료시키고, UV-spectrophotometer를 이용하여 540 nm에서 측정하였다.
2.3.2 미생물 전처리 및 볼밀 처리에 따른 α-셀룰로오스 변화 검토
48시간 미생물 전처리된 α-셀룰로오스에 lysozyme을 처리(1시간, 80℃)하여 미생물을 사멸시키고, 증류수로 3회 이상 감압여과하여 수세하였다. 이후 동결건조를 통해 기계적 처리 시료로 제조하였다. 기계적 처리를 수행하기 위해 α-셀룰로오스를 1%(w/v)으로 설정하고 볼밀(Wisemix ball mill, BML-6, Daihan scientific co., Ltd., Korea)를 이용하여 500 rpm, 2, 4, 6시간 동안 처리하여 분석을 실시하였다.
2.3.3 물리·화학적 특성 분석
2.3.3.1 형태적 특성 분석
미생물 전처리된 α-셀룰로오스를 분석하기 위해 SEM (Scanning Electron Microscope, EM-30, Coxem, Korea)을 이용하였다. 준비된 시료는 이온코팅기(KIC-1A, Coxem, Korea)로 5 mA, 180초 동안 Au 코팅을 실시하였으며, 가속전압 조건(20 kV)에서 관찰하였다. 또한 미생물 및 기계적 처리(6시간)된 α-셀룰로오스는 TEM (Transmission Electron Microscope, Tecnai G2 spirit TWIN, 20-120 kV/LaB6, USA)을 이용하여 관찰하였다.
2.3.3.2 물리적 특성 분석
기계적(Ball mill) 처리에 따른 α-셀룰로오스 특성 변화를 평가하기 위해 XRD(X-Ray Diffractometer, Ultima Ⅳ, Rigaku Co., Japan) 분석을 수행하였다. X선은 Cuα 튜브를 사용하였으며, 40 kV, 30 mA의 조건에서 2ϴ = 5–40°의 범위를 1°/min의 속도조건으로 측정하였다.
3. 결과 및 고찰
3.1 미생물 생장조건에 따른 최적 배양 조건 평가
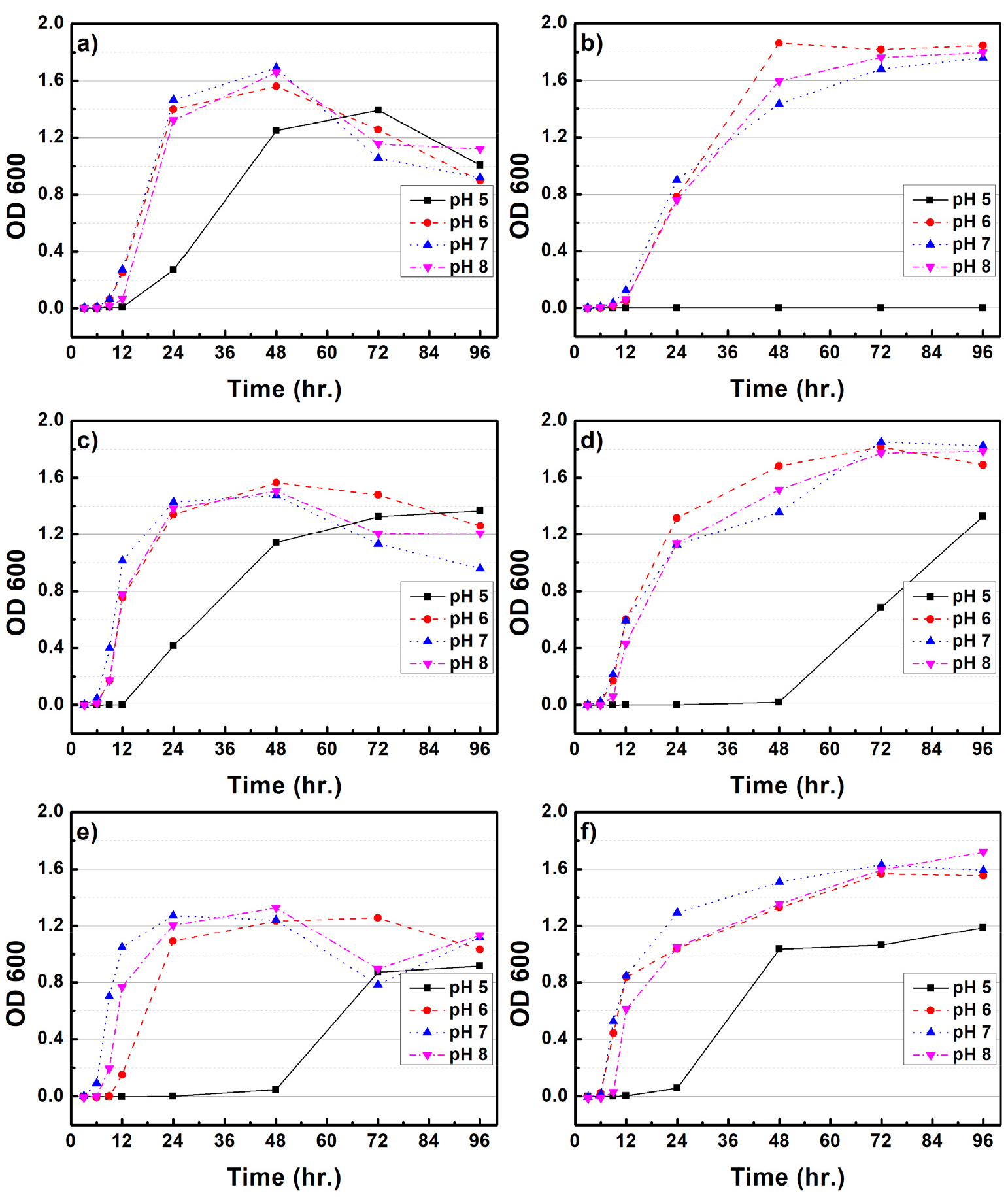
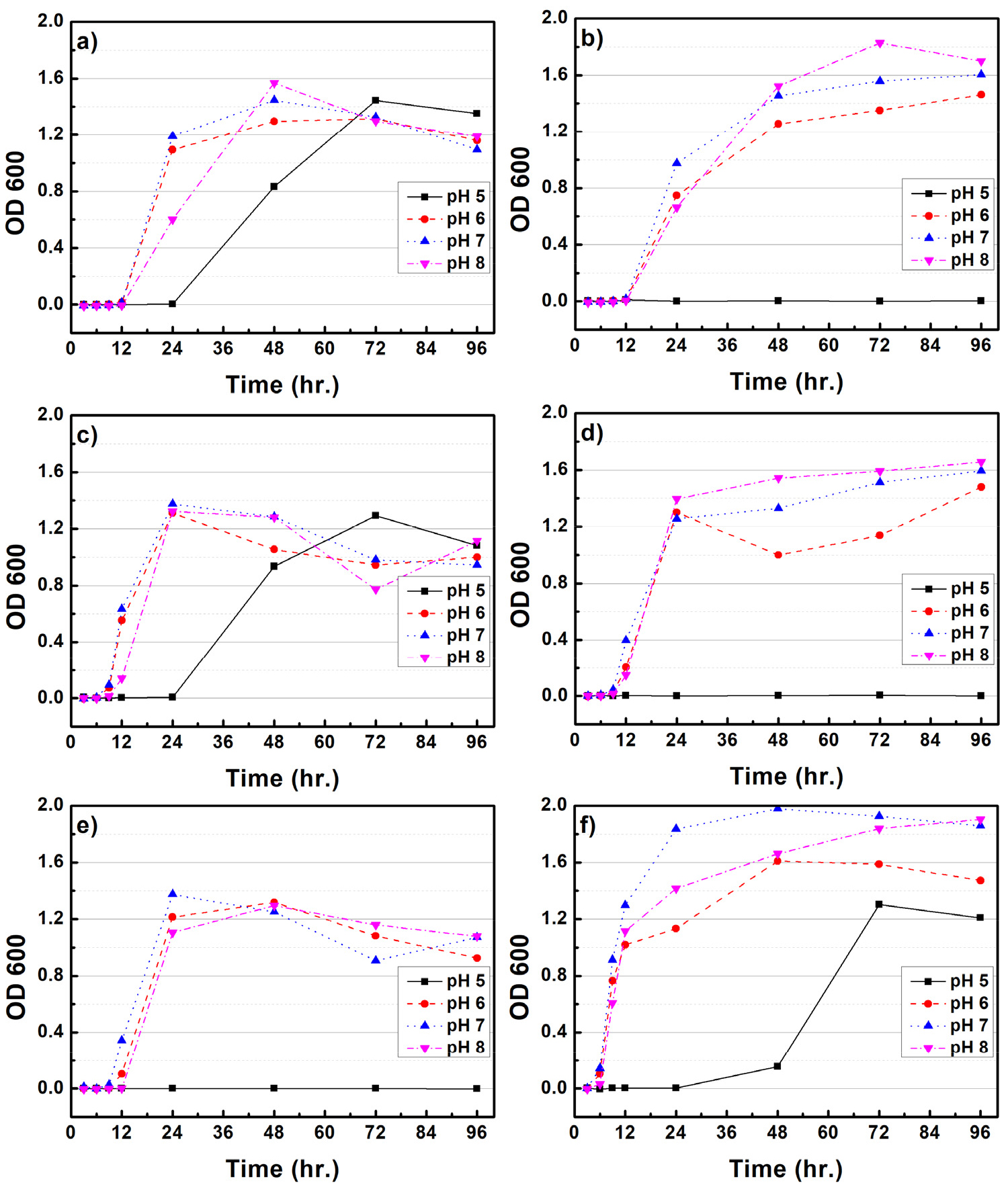
Figs. 1과 2는 CMC 배지 내 배양조건(rpm, pH, 온도)에 따른 B. subtilis와 B. licheniformis 균주의 생장 특성을 평가하였다. 100 rpm의 배양조건에서 B. subtilis와 B. licheniformis는 25℃에서 35℃로 배양온도가 증가함에 따라 최대 생장량이 감소되는 것으로 나타났다. B. subtilis는 약 48시간 배양하였을 때 최대생장을 보였으며, B. licheniformis는 72시간까지 지속적인 생장을 보였다. pH에 따른 생장 변화는 pH 5를 제외하고 pH 6, 7, 8에서는 큰 차이가 확인되지 않았다. 150 rpm 배양조건에서 B. subtilis는 25℃를 제외하고 최대 생장량이 감소되었다. pH에 따른 영향은 pH 5를 제외하고 6, 7, 8에서 거의 유사한 생장을 보였다. 반면 B. licheniformis는 25℃에서 35℃로 배양온도가 증가되면 초기 세포 생장량도 크게 증가되는 것으로 나타났다. pH 5를 제외하고 6, 7, 8에서 큰 차이점은 확인되지 않았다. B. subtilis의 최적생장 조건은 100 rpm, 25-30℃, pH는 6-8 사이로 생장 조건이 크게 민감하지 않은 것으로 사료된다. B. licheniformis의 경우 150 rpm, 35℃, pH 7이 최적생장 조건임을 확인할 수 있다. 다만 배양 온도가 증가함에 따라 초기 세포 증가 속도도 함께 증가되는 것으로 확인되었다. Li 등(2019)9)은 B. subtilis의 최적배양온도는 32℃로 보고하였으며, Xiong 등(2010)10)은 B. licheniformis가 pH 7.2, 배양온도 37℃에서 최적생장을 한다고 보고하였다. 본 연구에서도 최적생장 조건이 이전 연구들에서와 유사한 온도 및 pH인 것으로 보아 다양한 종류의 미생물 중 이들과 유사한 활성을 가지는 균주임을 확인할 수 있었다.
3.2 미생물 생장에 따른 환원당 생산 효율
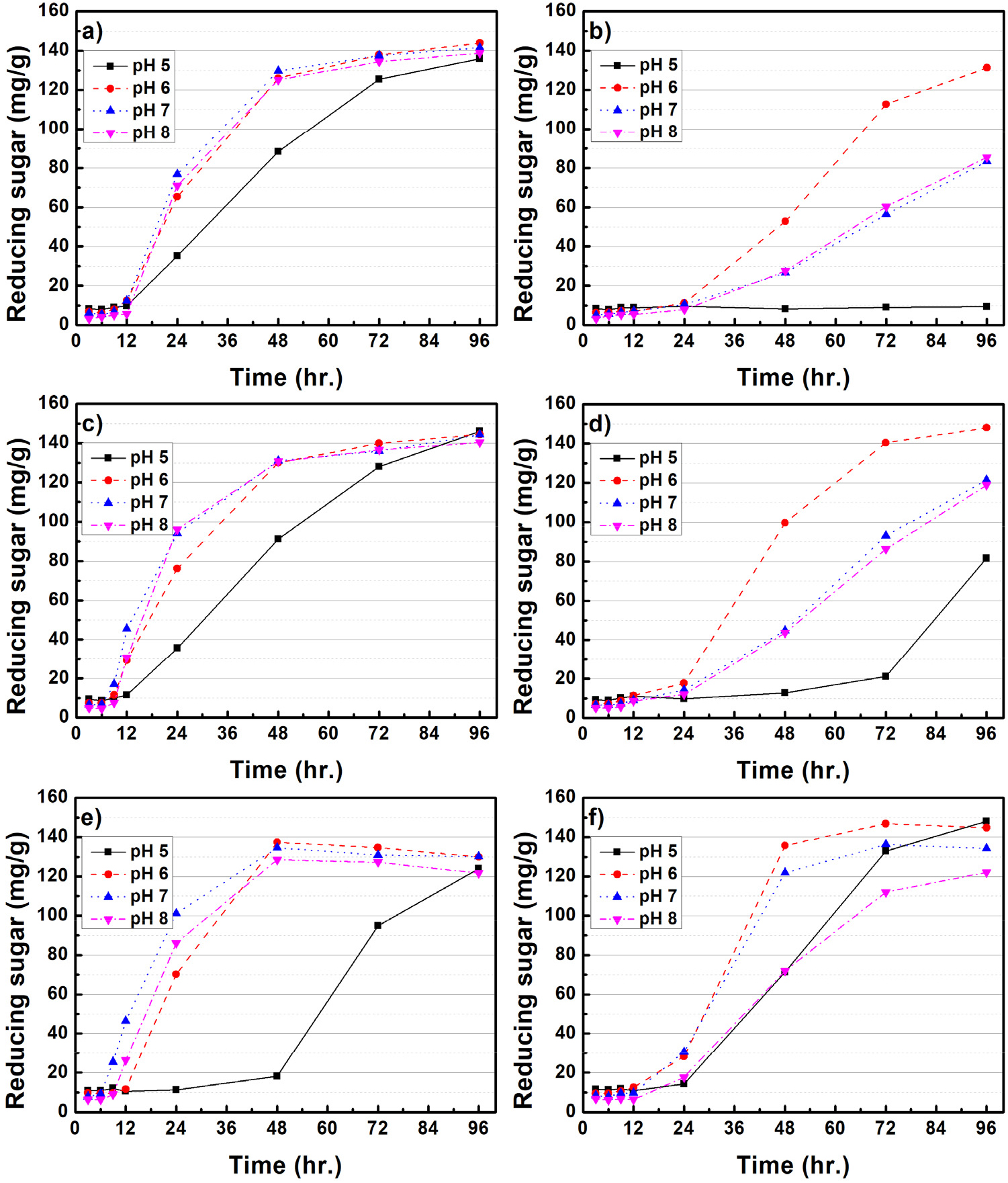
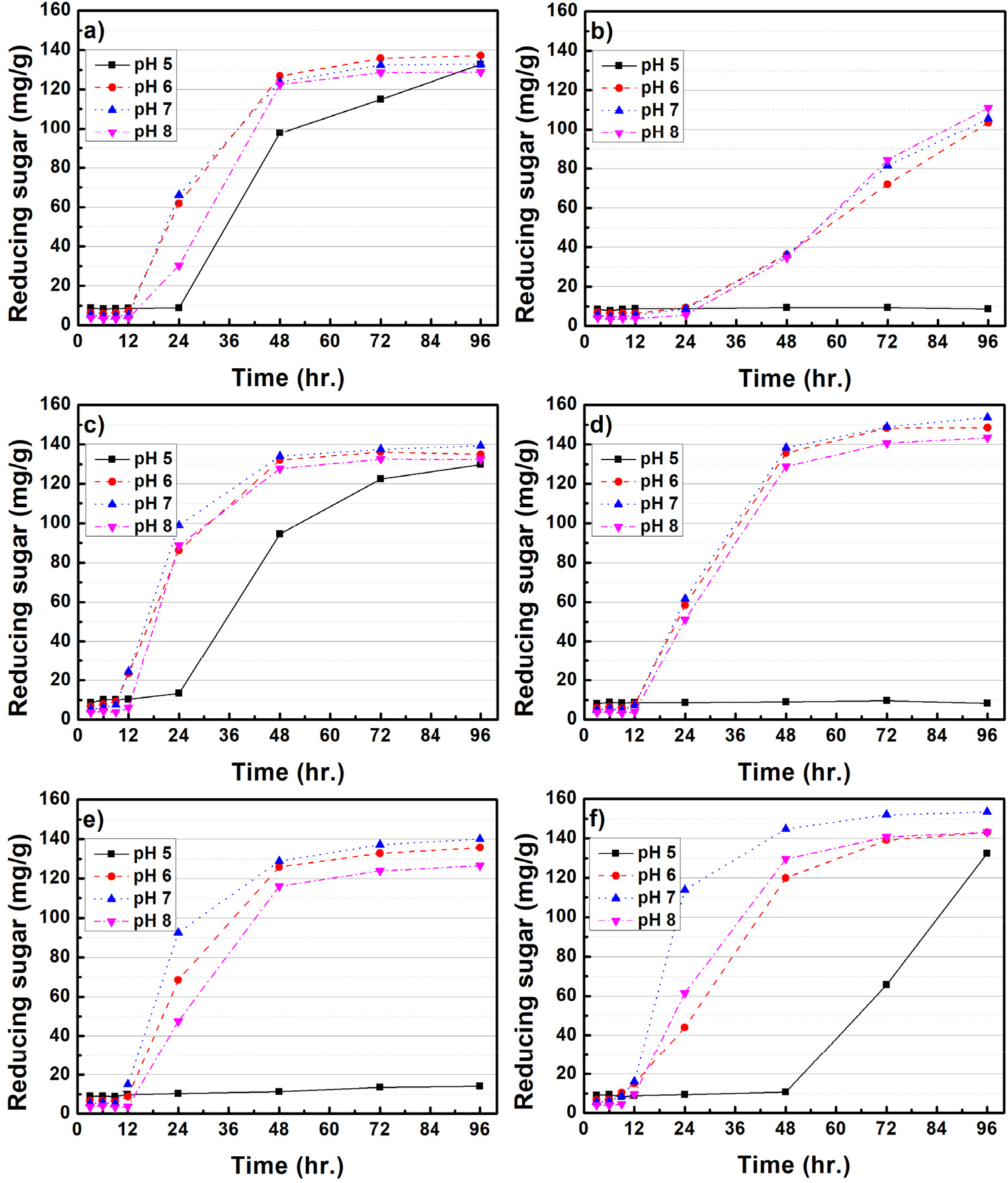
Figs. 3과 4는 미생물 처리된 CMC 배지 내 배양조건(rpm, pH, 배양온도)에 따른 환원당 생산 효율을 평가하였다. B. subtilis를 처리한 경우, 모든 온도와 rpm 배양조건에서 pH 6-8은 유사한 환원당 생산 효율을 보여주고 있다. Goyal 등(2014)11)은 B. subtilis가 pH 8 조건에서 가장 효소활성이 증가된다고 보고하였는데, 본 연구 결과에서는 pH 6-8 사이의 큰 차이점은 나타나지 않았다. B. subtilis는 pH 5를 제외하고, 모든 온도와 rpm 조건에서 유사한 환원당 생산 효율이 나타나 정밀한 환경조절 없이 환원당 생산이 가능한 것을 알 수 있다. 반면, B. licheniformis는 100 rpm의 상대적으로 느린 배양조건에서는 온도와 pH에 따른 영향이 크게 나타나지 않았으며, 150 rpm으로 배양조건이 변화되었을 때, pH 7, 35℃의 배양조건에서 가장 많은 환원당이 생산되는 결과가 확인되었다. Doan 등(2021)12)은 B. licheniformis의 효소활성이 pH 6-7, 35℃, 150 rpm에서 가장 높다고 보고하였는데 본 연구 결과와 유사한 것으로 판단되었다. 한편, 배양조건에 따른 환원당 생산 효율은 B. subtilis의 pH 5를 제외하고, 온도, rpm에 따라 큰 차이가 없지만, B. licheniformis의 경우 pH, rpm, 온도에 민감하게 반응하는 것으로 나타났다. 각각의 미생물은 같은 배양조건에서 성장 및 효소에 대한 반응이 다른데, 이는 유전체 구성, 기능성 단백질 등의 차이에서 발생한 것으로 사료된다.
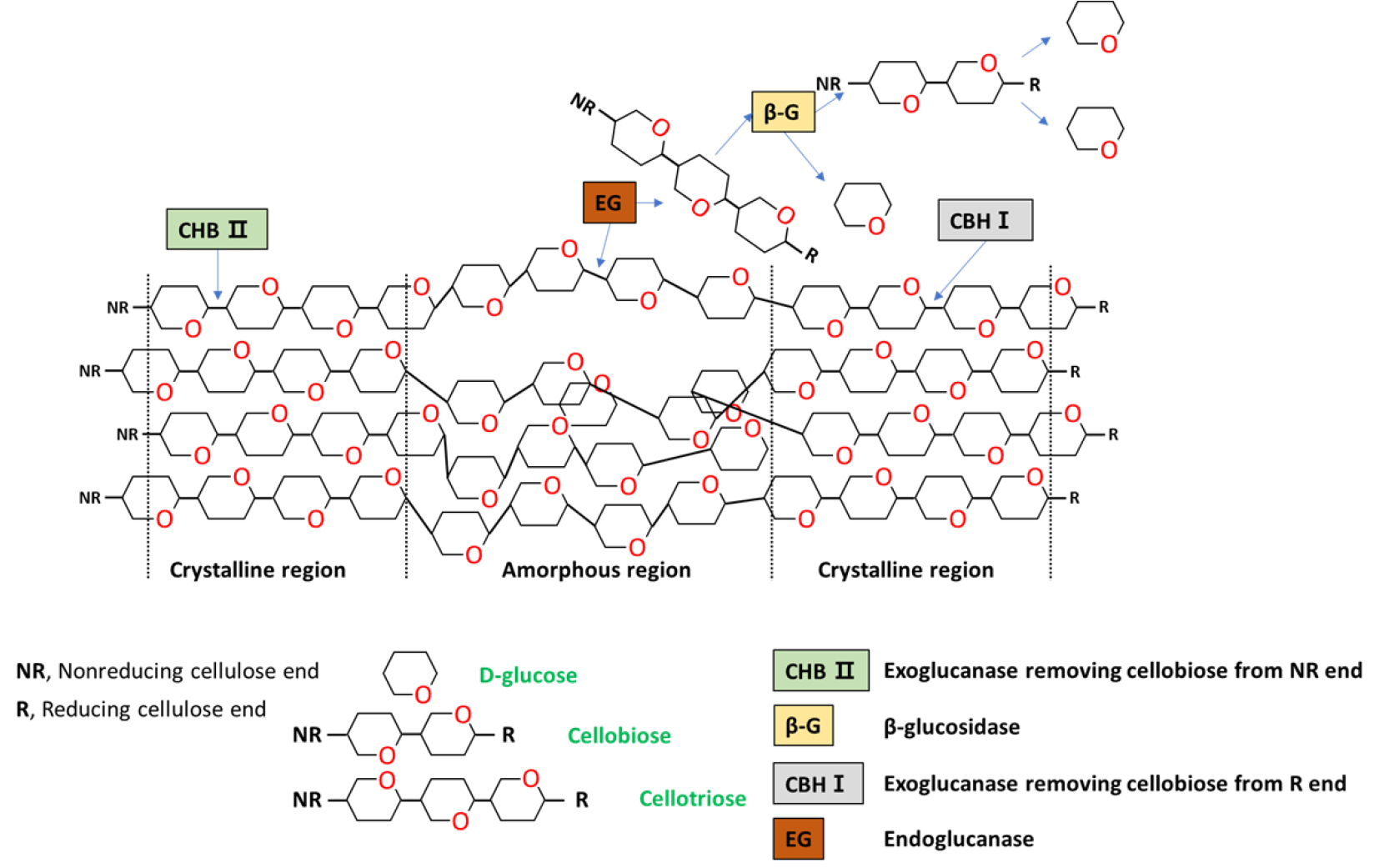
Fig. 5는 미생물 처리에 따른 셀룰로오스 분해 메커니즘을 개략적으로 보여주고 있다.13,14)B. subtilis와 B. licheniformis와 같은 Bacillus spp.에서 생산되는 효소(cellulase)는 대표적으로 세 가지 유형이 알려져 있으며, 가장 먼저 endo-β-1,4 glucanase(EC 3.2.1.4)의 경우 셀룰로오스 섬유의 내부 수소결합을 끊을 수 있다. 두 번째 exo-β-1,4-glucanase(EC 3.2.1.91)로 알려진 효소는 셀룰로오스에 존재하는 환원성 및 비환원성 말단에 결합 및 반응하여 짧은 이당류를 생성한다. 마지막으로 β-glucosidase(EC 3.2.1.21)는 cellobiose를 가수분해하여 단당류인 glucose를 생성하여 미생물의 에너지원으로 사용된다. 본 연구에서는 위와 같은 메커니즘을 바탕으로 셀룰로오스를 분해하여 환원당이 생성된 것으로 사료되었다. 한편 α-셀룰로오스에 미생물을 처리하였을 때, B. subtilis와 B. licheniformis의 최대 환원당 생산은 각각 21.7, 17.1 mg/g으로 CMC 대비 환원당 생산이 크게 감소하였다. 이는 α-셀룰로오스가 CMC와 비교하여 결정성이 높기 때문에 미생물이 효소를 생산하여 환원당으로 유도하는 것이 어려운 것으로 판단되었다.
3.3 미생물 전처리에 따른 α-셀룰로오스 특성 변화
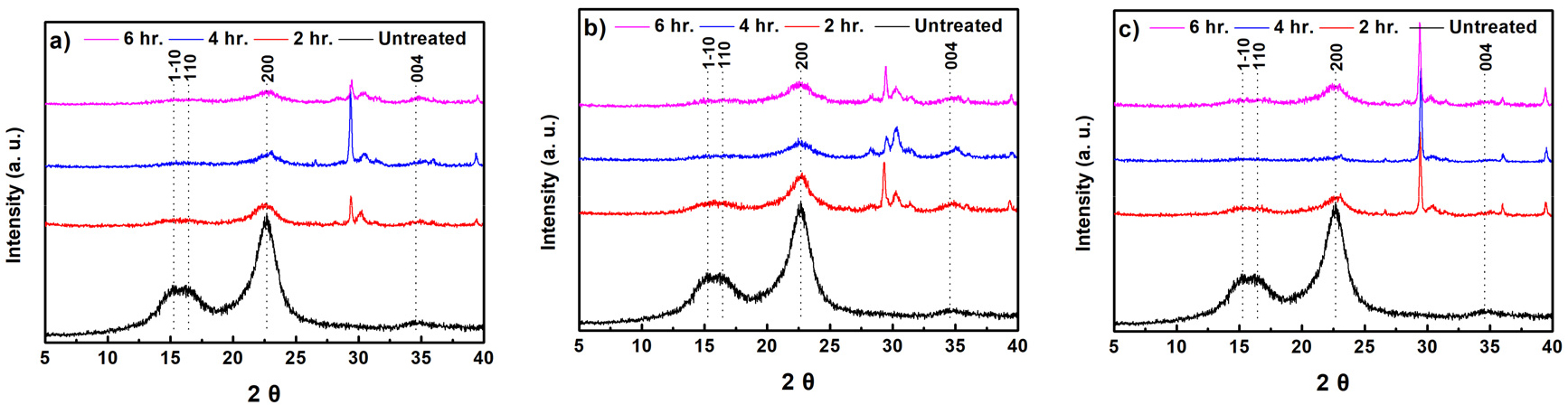
Fig. 6은 무처리 및 미생물 전처리 이후 기계적 처리된 α-셀룰로오스의 결정구조 특성 변화 그래프이다. α-셀룰로오스는 천연 셀룰로오스로서 cellulose Ⅰ형 결정구조 특성피크인14.7°(1-10), 16.8°(110), 22.7°(200), 34.6° (004)가 관찰되었다.15) 미생물 전처리 및 볼밀 처리된 α-셀룰로오스의 경우, 동일한 결정구조 피크가 확인되었는데, 이는 미생물 전처리 및 기계적 처리에 의한 셀룰로오스 결정구조 변화는 없는 것으로 판단되었다. 한편, 일부 문헌에서는 효소반응을 진행하여도 목재펄프 결정화도에 영향을 주지 못하는 것으로 확인되었다.16) 이는 효소반응과 관련하여 다양한 조건(온도, 시간, 효소의 농도)이 작용하는데, 본 연구에서는 미생물에서 생산되는 효소가 결정화도가 높은 α-셀룰로오스에 큰 영향을 주지 못하기 때문에 결정화도 변화는 없다고 판단하였다. XRD 피크에서 전체적으로 볼밀 처리시 무처리 셀룰로오스에 비해 XRD 피크 강도(intensity)가 낮아지는 것이 확인되었다. 이는 기계적 처리 도입에 의해 셀룰로오스 결정구조가 일부 파괴되기 때문으로 사료된다.17) 이에 따라 α-셀룰로오스 결정구조는 미생물에 의한 전처리보다 기계적 처리에 따른 결정구조 파괴가 큰 영향을 주는 것으로 판단된다.
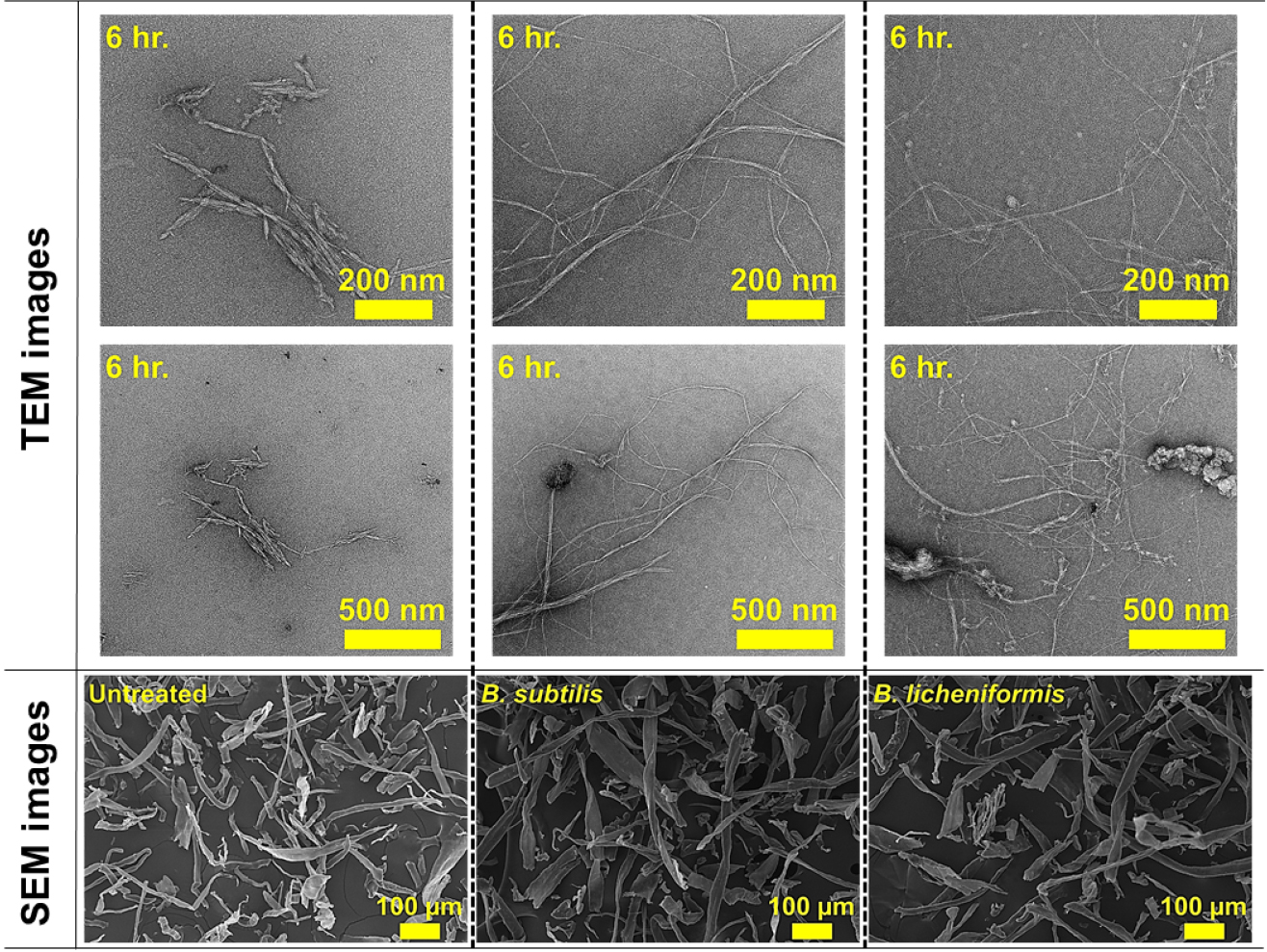
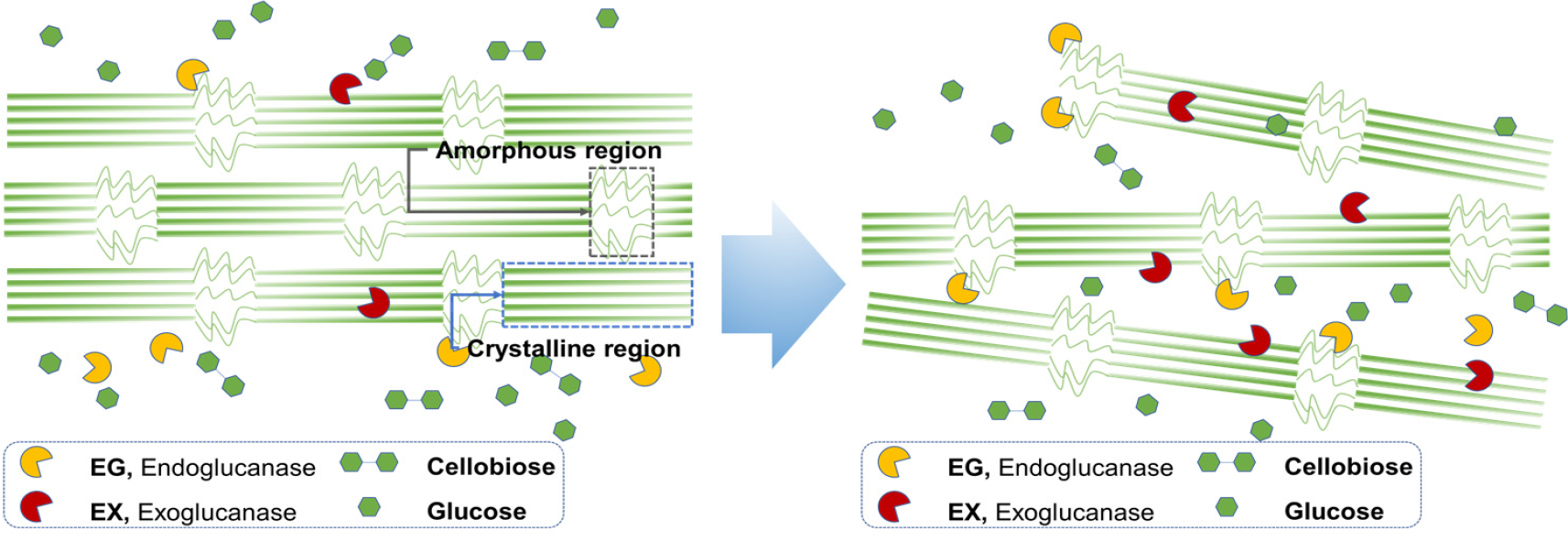
Fig. 7은 미생물 전처리 후 기계적 처리된 α-셀룰로오스의 SEM 및 TEM 이미지이다. 무처리뿐만 아니라 미생물(B. subtilis, B. licheniformis) 전처리된 셀룰로오스 섬유도 모두 매끄러운 표면을 보여주고 있다. 그러나 미생물 전처리 후 기계적 처리가 수행된 셀룰로오스 섬유에서는 특징적인 변화가 관찰되었다. 기계적 처리만 수행된 무처리 셀룰로오스는 길이가 짧은 CNF가 확인되었지만, B. subtilis와 B. licheniformis가 각각 전처리 및 기계적 처리된 셀룰로오스에서는 길이가 긴 CNF가 제조되었다. Rao 등(2015)18)은 물이 첨가되어 볼밀 처리된 경우, 셀룰로오스 사이에 물이 침투되고 볼의 충격과 마찰로 인해 CNF 제조가 가능하다고 하였다. 무처리의 경우, 볼밀 처리 시 상대적으로 약한 셀룰로오스의 비결정영역이 깨지면서 짧은 길이의 CNF가 제조된 것으로 판단된다. Fig. 8은 미생물에서 생성되는 효소가 셀룰로오스 섬유에 미치는 영향을 보이고 있다. Dias 등(2022)19)의 연구에 따르면 endoglucanase와 exoglucanase를 함께 셀룰로오스에 처리하였을 때, endoglucanase 효소의 비율이 더 높으면 셀룰로오스 섬유의 팽윤 및 섬유화가 촉진되어 길이가 긴 CNF가 제조된다고 보고하였다. 본 연구에서 사용된 미생물(B. subtilis, B. licheniformis)로부터 생산된 효소로 인해 α-셀룰로오스의 팽윤 및 섬유화가 진행되었고, 이후 기계적 처리로 길이가 긴 CNF가 제조되는 것으로 확인된다. 따라서 미생물 전처리를 적용할 경우, 미생물에서 생산되는 효소로 인해 셀룰로오스 사슬의 수소결합을 약화시키고, 볼의 충격과 마찰로 인해 상대적으로 길이가 긴 CNF가 생성된 것으로 사료된다.
4. 결 론
본 연구는 셀룰로오스 분해효소를 생성하는 미생물(Bacillus subtilis, Bacillus licheniformis)이 셀룰로오스에 미치는 영향을 평가하고자 하였다. B. subtilis는 pH 5 조건에서 초기생장이 제한되었으며, 배양온도가 25℃에서 35℃로 증가함에 따라 세포 생장이 감소되는 경향을 나타냈다. B. licheniformis는 pH 5를 제외하고 대부분 유사한 초기생장이 확인되었으며, 최적 배양조건은 35℃, 150 rpm, pH 7로 나타났다. 배양조건에 따른 CMC 기반 환원당 생산량은 B. subtilis의 경우, pH 5를 제외하고 나머지 조건에서 유사하게 나타났으며, 온도 및 rpm에 따라서도 큰 차이점이 관찰되지 않았다. 반면 B. licheniformis는 pH 7, 35℃ 조건이 가장 최적조건으로 확인되었다. 미생물 전처리가 셀룰로오스에 미치는 영향은 B. subtilis가 B. licheniformis보다 배양환경(pH, rpm, 온도)의 영향을 더 적게 받기 때문에 B. subtilis의 활용이 더 쉬울 것으로 판단된다. 미생물 전처리 및 볼밀 처리된 셀룰로오스는 cellulose Ⅰ형으로 결정구조에는 영향을 미치지는 않았지만, XRD 피크 강도(intensity)가 감소된 것으로 보아 셀룰로오스 결정영역에 영향을 준 것으로 사료된다. 무처리 및 기계적 처리된 α-셀룰로오스는 길이가 짧은 CNF가 제조되었지만, 미생물 전처리 이후 기계적 처리된 α-셀룰로오스는 무처리와 비교하여 상대적으로 길이가 긴 CNF가 제조되었다. 미생물 전처리 및 기계적 처리된 CNF는 종횡비가 크기 때문에 기계적 특성을 향상시키는 보강제, 페인트 등의 점도를 높이는 증점제 등에 활용될 수 있을 것으로 기대된다.