1. 서 론
2. 재료 및 방법
2.1 HLE-기반 배지를 이용한 레반의 생산
2.2 배양 이후 레반의 정제와 탈색 최종산물의 분석
3. 결과 및 고찰
3.1 HLE에서 P. chlororaphis 배양
3.2 레반의 정제 및 탈색
4. 결 론
1. 서 론
미이용 산림바이오매스란 산림경영, 가로수 조성 및 관리, 자연재해 등으로 발생한 산림부산물 중 활용이 원활하지 않은 산물을 의미한다.1) 벌채 부산물, 병충해 및 산불, 수해 등과 같은 자연재해 피해목, 가로수 산물과 같은 미이용 산림바이오매스 중 목질부 유래의 경우 목재칩 또는 목재펠릿으로 가공되어 신재생에너지원으로 사용되지만, 낙엽은 현재까지 뚜렷한 활용처가 없는 실정으로 일반폐기물로 간주된다.2,3) 낙엽은 자연환경에서 퇴비로 분해되어 토양의 비옥도를 향상하는 이점이 있지만, 산불의 촉매제로 작용해 막대한 재산 피해와 대기 오염을 일으킬 수 있으며,4)도심 가로수에서 발생하는 낙엽은 도로 등에 방치되어 배수로를 막아 홍수를 유발하고, 수질오염을 일으키기도 한다.5) 현재 국내에서는 낙엽을 생활폐기물로 분류하여 소각 처리하는데, 매립장 및 소각장의 감소에 따라서 처리비용이 증가하고 공해 물질을 발생시켜 경제적인 손실과 환경피해를 유발한다.6)이와 같은 문제를 해결하고자, 소각처리 대신 낙엽을 이용한 기능성 펄프몰드, 발효를 통한 바이오수소 생산용 원료, 낙엽 기반 그래핀 합성 등 고부가가치 산물로 활용하는 방법이 모색되고 있다.7,8,9)
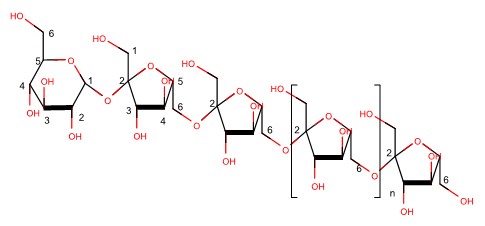
낙엽은 셀룰로오스, 헤미셀룰로오스, 그리고 리그닌의 세 가지 생체고분자 물질로 이루어진 리그노셀룰로오스를 주성분으로 구성되어있다.10,11) 기존 연구에 따르면,12) 활엽수재 낙엽추출물(Hardwood fallen leaf extract, HLE)에 특정 보충물을 첨가하면 Pseudomonas 속 미생물의 경제적 배양이 가능하다는 결과를 제시한 바 있다. Pseudomonas 속 미생물들은 배지 조성에 따라서 바닐린(vanillin),13) 폴리하이드록시알카노에이트(polyhydroxyalkanoates, PHA)와 람노리피드(rhamnolipids),14)레반(levan)15) 등의 다양한 산업적으로 가치가 높은 대사산물을 생산하는 능력을 지닌 원핵생물이다. 그 중 레반은 β-(2,6)-glycosidic 결합으로 연결된 Fructofuranosyl 고리로 구성된 β-fructan (과당중합체) 구조(Fig. 1)의 다당류로16) 일부 식물체 내 저장탄소원으로 축적되거나 미생물 발효 중 세포 외부로 분비하는 생물막(biofilm)의 구성성분으로 물리적, 화학적 안정성이 뛰어나다는 특징을 갖는다.17)
물리·화학적 안정성 외에도 레반은 생체 적합성, 생분해성, 유연성과 같은 특성과 항산화, 항염증, 항암, 항에이즈, 고혈당 억제 등의 생리학적 활성을 가지고 있어 다양한 산업 분야에서 활용할 수 있다.18) 특히, 레반의 뛰어난 인장 및 전단 강도의 특성으로 인하여 수성 및 가교 접착제의 소재로써 활용19)될 수 있으므로 종이 기반의 용지, 포장지, 코팅지, 화폐 등 기계적 강도가 중요한 펄프 및 종이 산업 분야에서 레반이 보강재로도 활용될 수 있다.20)
본 연구에서는 HLE-기반 미생물 배지의 산업적 활용 가능성을 확대하고자 HLE 배지에 자당을 첨가한 뒤 Pseudomonas chlororaphis 균주를 배양하여 레반의 생합성을 유도하였다. 배양 중 소모되는 자당 및 생산되는 레반은 고성능액체크로마토그래피(High pressure liquid chromatography, HPLC)를 통해 정량분석하였고, 세포성장도는 분광광도법으로 분석하였다. 생산된 레반은 여과법을 통해 정제하였으며, 정제효율 역시 HPLC로 분석하였다. 추가적으로 HLE-기반 배지가 가지고 있는 짙은 색은 레반의 산업적 이용에 제한을 초래하므로 이를 제거하기 위해 활성탄, 이온교환수지 등의 탈색제를 처리한 뒤 처리량 및 반응시간 등의 최적 조건을 확립하며 연구를 마무리하였다.
2. 재료 및 방법
2.1 HLE-기반 배지를 이용한 레반의 생산
HLE-기반의 배지는 지난 연구를 기반으로 제조하였다.12) 간단히 기술하자면, 강원대학교 구내림에서 확보한 낙엽 150 g을 3 L 증류수를 이용하여 추출물을 제조한 뒤, 효모추출물, 트립톤, 염화수소를 각각 0.5, 1, 5 g/L의 농도로 첨가하였다. 준비한 HLE-기반 배지를 이용하여 레반을 생산하기 위해 자당을 20 g/L 농도로 첨가한 본 배양액을 제조하였다. 제조에 사용된 효모추출물 및 트립톤은 벡톤디킨슨(Difco BD, 프랭클린 레이크, 뉴저지, 미국), 염화수소는 시그마-알드리치(Sigma-Aldrich, 세인트 루이스, 미주리, 미국)로부터 구입하여 사용하였다. 레반 생산을 위한 Pseudomonas chlororaphis KCTC 52142 균주는 Korea Collection for Type Culture로부터 구입하였다(KCTC, 정읍, 대한민국). P. chlororaphis는 3 mL의 Luria-Bertani (LB, Difco BD) 배지에서 30°C 180 rpm 조건으로 16시간 동안 종균배양을 진행한 뒤, 자당을 함유한 30 mL의 본 배양액에 1 mL 종균배양액을 첨가하여 동일한 조건에서 3일간 배양을 진행하였다. 배양 중 12시간 간격으로 배양액을 채취하여 세포 성장도 및 당류 분석을 수행하였다. 세포 성장도는 분광광도계(Ultrospec 2100 pro, Amersham, UK)를 이용하여 600 nm의 파장에서 혼탁도 측정을 통해 결정하였으며, 배지 내 자당 분해능 및 레반 생산능은 HPLC 정량분석을 통해 농도를 계산한 뒤 아래 식 [1], [2]를 이용하여 각각 계산하였다.
여기서 는 자당의 소비율을 의미하고 는 배양 초기 자당 농도, 는 72시간 배양 후 자당 농도를 의미한다. 또한 는 레반 전환율을 의미하고 는 배양 초기 자당의 농도, 는 72시간 배양 후의 생성된 레반의 농도를 의미한다.
HPLC 분석은 굴절율 검출기가 장착된 YL-9100 System (영인크로매스, 안양, 대한민국)에 Shodex KS-802 Column (7µm, 8 mm × 300mm, Showa Denko K. K., 도쿄, 일본)을 장착하여 분석하였다. 이동상으로는 물을 1.0 mL/min의 유속으로 사용하였으며 컬럼 및 검출기의 온도는 각각 80°C, 50°C로 유지하였다. 표준곡선 설정을 위해 사용한 자당 및 레반은 각각 시그마-알드리치와 셀라피바이오(대전, 대한민국)로부터 구입하여 사용하였다.
2.2 배양 이후 레반의 정제와 탈색 최종산물의 분석
배양 상등액으로부터 레반을 정제하기 위해 여과법을 사용하였다. 이를 위해 먼저 8,000 rpm의 조건에서 원심분리를 통해 세포를 제거하였다. 이후 Merck사의 50 kDa 분리 한계를 갖는 Ultra 15 Centrifugal Filters (Merck, 다름슈타트, 독일)에 배양 상등액을 옮긴 뒤, 3,450 rpm, 4°C에서 120분 동안 원심분리를 통해 한외여과를 수행하였다. 이후 투석여과를 위해 증류수 14.5 mL을 첨가하여 동일한 조건에서 100분 원심분리를 2회 수행하였다. 정제효율은 HPLC를 통해 분석하였다.
HLE-기반 배지로부터 생산된 레반의 탈색을 위해 3종의 활성탄 및 5종의 이온교환수지를 정제된 레반용액에 처리하였다. 사용한 활성탄 및 이온교환수지의 정보는 Table 1과 같다. 8종의 탈색제 중 최적의 탈색제를 선정하기 위하여 HLE에 각 탈색제를 10% (w/v)로 첨가한 뒤 18시간 동안 회전교반 반응을 수행하였다. 선정된 탈색제의 최적 조건을 확립하기 위하여 다양한 처리량(1~5%, w/v) 및 처리시간(0~24시간)에 따른 탈색효율을 분석하였다. 이후, 최적의 탈색조건에서 정제된 레반의 탈색반응을 수행하였다. 탈색제에 의한 탈색효율은 분광광도계를 이용하여 440 nm에서 광학 밀도값을 측정한 뒤, 아래 식 [3]과 같이 계산되었다.
여기서 는 탈색효율을 의미하고 는 HLE의 흡광값, 는 탈색제 처리 후 시료의 흡광값을 의미한다.
분석결과 시료의 흡광값이 0 미만인 경우에는 탈색율을 100%로 산정하였다.
Table 1.
Brief information of the decolorization materials used in this study
정제 및 탈색을 거친 최종산물이 레반임을 확인하기 위해서 퓨리에-변환 분광법(Fourier transform -infrared spectroscopy, FT-IR)를 수행하였다. 이를 위해 최종산물의 동결건조를 수행하였다. 동결건조는 FDB-5503(오페론, 김포, 대한민국) 장비를 이용하여 수행하였으며, FT-IR 분석은 강원대학교 공동실험실습관에서 iS50 (Thermo ScientificTM, 매사추세츠, 미국) 장비를 활용하여 수행하였다.
3. 결과 및 고찰
3.1 HLE에서 P. chlororaphis 배양
자당은 포도당과 과당의 글리코사이드 결합으로 이루어진 이당류로 여기에 invertase (EC. 3.2.1.26) 같은 효소가 작용하면 생명체가 가장 선호하는 탄소원인 포도당과 과당으로 분해된다.21)P. chlororaphis 균주는 invertase 변이체의 한 종류인 levansucrase라는 효소를 분비하는 특성을 지니고 있는데, 이는 자당을 포도당과 과당으로 분해하면서 생성되는 유리 과당을 연속적으로 다른 자당의 과당분자에 연결하는 기작을 수행한다.22) 따라서 자당을 함유한 배지에 levansucrase를 생산하는 균주를 배양하면, 효소작용에 의해서 자당이 포도당과 과당으로 분해되면서 과당중합체가 형성되고, 포도당은 세포 성장을 위한 탄소원으로 활용될 수 있다. 본 연구에서도 이 특성을 응용하여 자당으로부터 세포 성장 및 레반의 생합성을 유도하였다. Fig. 2a에서 볼 수 있듯이 자당을 함유한 HLE 배지에서 P. chlororaphis 균주는 배지 내 자당을 활용하여 배양 시간에 따라 꾸준히 성장함을 확인하였다. 동시에 해당 균주는 과당중합체인 레반을 생합성하여 72시간 이후 생산량은 7.2 ± 0.1 g/L에 도달하였다. Pseudomonas 속 미생물이 생산하는 레반은 고분자(high molecular weight) 형태의 레반을 합성하는 것으로 알려져 있다.23) 이 특성을 바탕으로 Fig. 2b에서 볼 수 있듯이 배지 내 생합성되는 레반은 당분석 컬럼이 장착된 HPLC를 통해 쉽게 분석할 수 있다. 종합적으로 Fig. 2의 결과는 해당 균주가 자당을 함유한 배지에서 levansucrase를 세포 외로 분비·발현하였음을 나타낸다. 배양 결과로 초기 19.6 ± 0.1 g/L의 자당을 72시간 동안 14.2 ± 0.6 g/L 소모함에 따라 자당 활용률은 72.5%로 결정되었으며, 이에 따른 레반 전환율은 36.7%로 기존에 알려진 levansucrase의 활성24)과 유사한 수준으로 판단된다. 따라서 기존 LB 배지와 같은 영양배지를 이용한 발효를 통해 생산하는 레반을 HLE-기반의 배지를 사용함으로써 고부가가치 산물의 생산단가를 크게 낮출 수 있음을 시사한다.
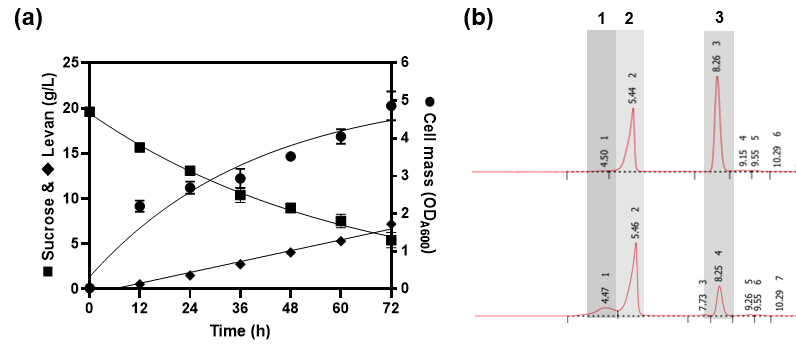
Fig. 2.
Microbial production of levan by P. chlororaphis in HLE media supplemented with sucrose. (a) shows the cell growth curve and saccharides profiles over the time. (b) depicts the HPLC chromatograms of the media and culture product after 72 hours of culture. In (b), 1, Levan; 2, Media components; 3, Sucrose.
3.2 레반의 정제 및 탈색
레반은 과당중합체로 다양한 미생물이 레반을 만들어낸다. 앞서 기술한 대로 Pseudomonas 속과 같은 그람 음성 세균이 만들어내는 레반의 경우 일반적으로 저분지 및 고분자 형태의 레반을 생합성하는 것으로 알려져 있으며 그 분자량은 크게 106 Da 이상을 갖는다고 알려져 있다.23) 따라서 미생물이 생산하는 고분자형 레반의 경우는 분자량 차이에 의한 한외 및 투석 여과법을 적용하여 손쉽게 정제할 수 있다.25) HLE-기반 배지로부터 생합성된 레반을 정제하기 위해 먼저 원심분리를 통해 세포를 제거한 뒤 배양 상등액을 50,000 Da의 분자량 차단 한계(molecular weight cut off)를 갖는 필터에 2회 적용하여 레반의 정제를 수행하였다. 실험 중 각 단계별로 샘플을 취하여 HPLC로 레반의 정제도를 분석하였다. 실험 결과, Table 2에 정리된 바와 같이 배양 상등액에는 레반 뿐만 아니라 배지 성분, 잔여 당 및 기타 세포 성장에 따른 대사산물로 추정되는 물질들이 탐지되었다. 하지만 한외여과를 통해 필터를 빠져나온 여액의 경우 레반을 제외한 기타 성분들만 탐지되어 레반이 성공적으로 필터 내에 잔존함을 확인하였다. 2회에 걸친 농축 및 투석 여과를 통해 99% 이상의 고순도 레반을 확보할 수 있었다.
Table 2.
Purification table of the produced levan using filtration (Unit: %)
| Levan | Media | Sucrose | Others | ||
| Culture supernatant | 16.6 | 57.9 | 21.6 | 3.9 | |
| Filtration | Flowthrough | 0.0 | 69.7 | 22.5 | 7.9 |
| 1stconcentrate | 98.8 | 0.0 | 0.3 | 0.9 | |
| 2ndconcentrate | 99.8 | 0.0 | 0.0 | 0.2 | |
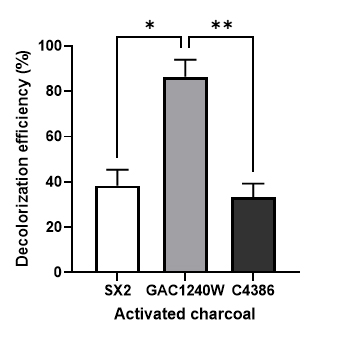
한외여과를 통해 HLE-기반 배지로부터 생합성된 레반을 손쉽게 정제할 수 있었으나, HLE 고유의 색소에 의해 정제된 레반은 짙은 갈색을 나타내었다. 발효를 통해 생산된 산물에 배지의 색소가 침착되는 현상은 산물의 산업적 응용을 제한하는 특성으로, 탈색과정을 통해 산물 내 색소를 제거하는 과정이 수반되어야 한다.26) 이를 위해 배지 탈색을 위해 사용되는 상용화 탈색제 8종(3종의 활성탄 및 5종의 이온교환 수지)을 이용하여 HLE의 최적 탈색조건을 탐색하였다. 먼저, 최적의 탈색제 선정을 위해 각 탈색제를 10% (w/v) 농도로 HLE에 처리한 뒤, 18시간 동안 반응하였다. 반응 후 원심분리를 통해 탈색제를 제거하고 분광광도계를 이용하여 탈색효율을 확인한 결과, 전반적으로 활성탄 계열이 이온교환수지 계열보다 탈색효율이 우수함을 확인하였다(Fig. 3). 따라서 1차로 3종의 활성탄을 선정한 뒤, 최적의 활성탄을 선정하는 실험을 수행하였다.
세 종의 활성탄(SX2, GAC1240W, C4386) 중 최적의 탈색제를 선정하기 위하여, 처리량을 1% (w/v)로 낮춘 뒤 동일한 조건에서 탈색반응을 수행하였다. 실험 결과, Fig. 4과 같이 3종의 활성탄 중 GAC1240W가 86.4 ± 5.4%의 탈색효율을 보여 HLE의 탈색을 위한 최적의 탈색제임을 확인할 수 있었다. GAC1240W의 경우 석탄 원료의 증기 활성화 과정을 거친 1 mm의 직경을 갖는 활성탄으로 음용수 및 산업용 액체 정화에 사용된다.27) 특히 높은 표면적에 따라 유기화합물,28) 농약,29) 악취30) 등을 제거하는데 효과적이라고 알려져 있다. 우리의 연구 결과와 유사하게 GAC1240W는 beet sugar syrup의 갈변된 색상 제거31) 에 사용된 바 있다. 이 특성에 비추어 볼 때, GAC1240W가 HLE에 함유된 짙은 갈색의 색소를 효과적으로 흡착한 것으로 사료 된다.
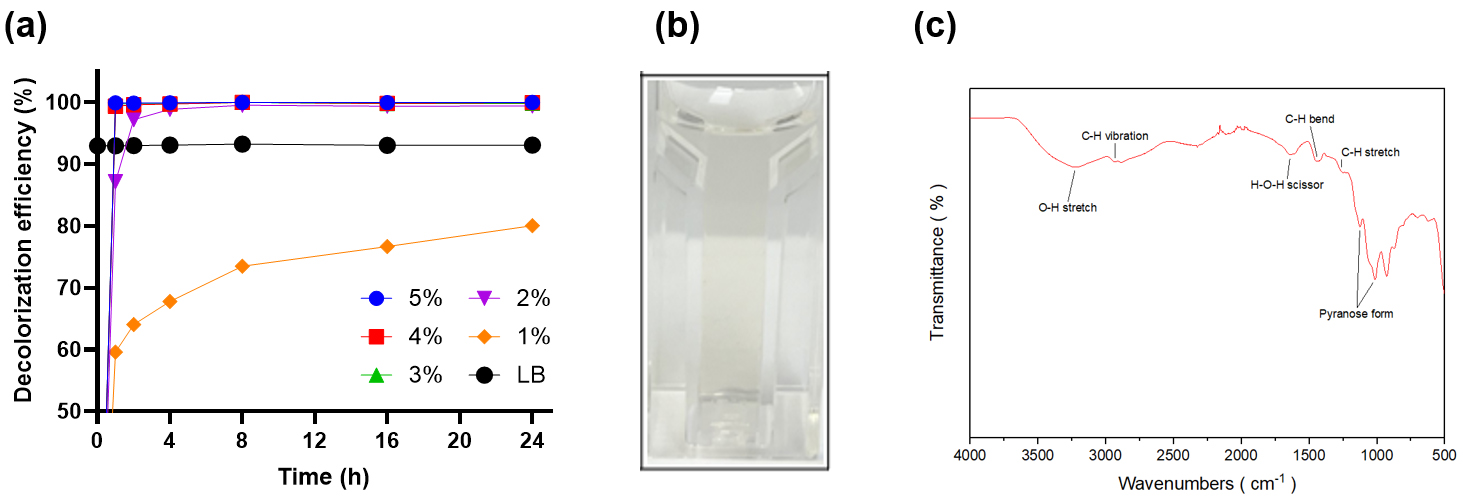
최적의 탈색제로 GAC1240W를 선정한 뒤, 우리는 추가적으로 HLE 배지의 완전 탈색을 위한 조건을 최적화하였다. 이를 위해 GAC1240W를 HLE에 1~5% (w/v) 처리량으로 최대 24시간까지 반응하여 탈색효율을 비교하였다. 실험 결과 Fig. 5a에 나타낸 바와 같이 1%의 처리량의 경우 반응시간을 증가함에 따라 탈색효율은 증가하였으나, 24시간 반응에도 불구하고 상용화 영양배지인 LB 배지 보다 짙은 색을 나타내었다. 반면 2% 이상의 처리량의 경우 2시간 이내 반응에서도 완전 탈색이 일어남을 확인할 수 있었다. 종합적으로 처리량 및 반응시간을 고려하여 HLE의 완전 탈색을 위해 GAC1240W를 2% 처리량으로 2시간 반응을 최적 조건으로 확립하였다. 이후, HLE-기반 배지에서 생산된 레반의 탈색을 확립된 최적 조건에서 반응한 결과, Fig. 5b와 같이 HLE-기반 배지에서 생산된 레반의 완전 탈색이 가능하였다.
정제 및 탈색 공정을 거친 최종산물이 레반임을 확인하기 위하여 화학적 구조분석으로 FT-IR을 수행하였다. FT-IR 분석 결과, 그림 Fig. 5c와 같이 최종산물은 기존 레반의 분석결과15,32)와 마찬가지로 3220 cm-1 부근의 O-H 피크, 2928.895 cm-1 부근의 C-H 피크가 관찰되었으며, 920–1100 cm-1 피라노스 지문영역을 나타내었다.
4. 결 론
본 연구에서는 미이용 산림바이오매스인 낙엽의 고부가가치화를 위해 낙엽추출물(HLE)에 기반한 미생물 배양 배지를 제조한 뒤, 산업적 응용 가능성을 확대하기 위해 HLE에 자당을 첨가한 배지에서 Pseudomonas chlororaphis를 배양함으로써 레반을 생산, 이를 정제 및 탈색하는 과정에 대해 연구하였다. 연구 결과, 자당을 첨가한 HLE 배지에서 P. chlororaphis의 72시간 배양을 통해 기존 영양배지와 유사한 수준의 레반 전환율이 확인되었으며, 이후 한외여과법을 이용하여 생산한 레반을 99% 이상의 수준으로 정제할 수 있었다. 추가적으로 HLE 배지 내 함유된 짙은 갈색 색소에 의해 나타나는 레반의 색을 제거하기 위한 탈색제 선정 및 최적화 과정을 통해 레반의 완전 탈색이 가능한 조건을 확립하였고, FT-IR 분석을 통해 최종산물이 레반임을 확인하였다. 이는 미이용 산림바이오매스인 낙엽이 초래하는 환경 및 처리비용 같은 사회적 문제를 해결함과 동시에 산업적 응용 가능성을 확인한 연구로, 향후 추가 연구를 통해 다양한 수종에서 확보한 낙엽추출물을 활용하여 특정 미생물 배양에 의한 고부가가치 산물 생산 가능성을 조사하여 낙엽의 응용성을 더욱 확대하고자 한다. 동시에 생산된 레반을 이용하여 종이 표면 코팅제 또는 접착제로써의 활용을 통해 소재의 내구성을 보완하여 기존에 이용되는 합성 물질을 대체 할 수 있는 친환경 기능성 소재로써의 산업적 활용 가능성을 모색하고자 한다.