1. 서 론
2. 재료 및 방법
2.1 공시재료
2.2 실험방법
2.3 리그닌 입자 특성
2.4 적외선분광스펙트럼을 통한 아세틸화 효율성 분석
3. 결과 및 고찰
3.1 AL 특성
3.2 초음파 전처리에 따른 리그닌 입자 특성
3.3 초음파 전처리에 따른 리그닌 아세틸화 반응 특성 및 효율성 평가
4. 결 론
1. 서 론
고등 육상식물의 세포벽을 구성하는 주요 구성 요소인 리그닌은 셀룰로오스 다음으로 목질계 바이오매스에서 가장 풍부한 중합체이자 방향족 화합물의 주요한 재생 가능 공급원이다.1) 일반적으로 리그닌 거대분자는 세 가지 C6–C3 유형의 페닐프로판(phenylpropane) 전구체인 p-hydroxyphenyl, guaiacyl, sinapyl alcohol 단위의 라디칼 중합에 의해 형성된다.2) 해당 단위의 다양한 결합 및 작용기로 인해 UV 차단능력, 열 안정성, 기계적 특성 등에서 우수한 특징을 보이며 동시에 저렴한 생산비용과 생분해성을 갖추고 있어 다른 고분자와의 혼합으로 생체 고분자의 가치 향상과 활용 가능성이 다수의 연구를 통해 밝혀진 바 있다.3,4,5)
하지만 리그닌의 무정형 3차원적 복잡한 결합구조 및 다량의 수산기 존재는 리그닌 구조 자체에 강한 극성을 부여하기 때문에 비극성 용매에 용해되는 고분자와의 혼합 시 혼화성이 낮다. 또한, 고분자 매트릭스를 형성하는 과정에서 리그닌의 응집이 발생하여 리그닌-고분자 복합체의 물성 저하를 야기하게 된다.6) 따라서 리그닌의 물리적, 화학적 개질 방법을 통한 고분자와의 상용성 향상이 필연적이다.
에스터화(esterification)는 화학적 개질 방법 중 하나로 수산기에 에스터 화합물을 형성시키는 방법으로 특히 acetic anhydride, acetyl chloride를 이용한 아세틸화(acetylation)가 대표적이다.7) 리그닌의 친수성 수산기를 소수성인 아세테이트(acetate)로 대체하는 리그닌 아세틸화는 수산기 사이의 강한 분자 간 결합이 감소하여 리그닌의 자가 응집을 감소시키고 다른 유기매체, 소수성 합성 고분자 간의 용해성을 향상하게 된다.8) Kim 등9)은 생분해성 고분자인 PBAT와 아세틸화 처리 리그닌을 이용하여 복합필름을 제조하였으며, 크라프트 리그닌에 견주어 볼 때 리그닌 응집 감소 및 분산성 향상으로 균일한 필름 제조 가능성을 보고한 바 있다. Sameni 등10)은 수종, 펄핑 방법이 다른 4가지 종류 리그닌의 아세틸화를 통해 다양한 유기용매에 대한 용해성을 평가하였고, 대부분의 아세틸화 처리된 리그닌은 우수한 용해성을 보였으며, 특히 분자량이 낮고 리그닌 지방족의 수산기 함량이 적을수록 더 나은 용해성을 나타냈다고 보고하였다.
하지만 기존의 리그닌 아세틸화 반응은 시간 소모적 측면에서 효율성이 떨어져 이러한 결점을 해결하기 위해 온도, 촉매, 입자크기, 반응기 등의 조건 변화로 효율성을 증가시키려는 노력이 경주되고 있다.11)Oliveira 등12)의 연구에 따르면 microwave 반응기에서 아세트산과 황산 촉매를 이용할 경우 리그닌 지방족 수산기만을 선택적으로 아세틸화하여 반응시간 감축 가능성을 밝힌 바 있다. 또한, Moradi 등13)은 리그노설포네이트를 micro emulsion 방법을 통해 나노 입자를 제조하여 아세틸화 공정의 온도와 시간소모를 줄이고 생산효율을 높여 리그닌의 화학적 개질 효율성 향상에 보다 효과적임을 보고한 바 있다. 또한, 긴 반응 시간은 리그닌 구조에 존재하는 에테르 결합의 절단을 선호하기에 탈아세틸화 반응으로 인한 치환도의 감소가 유발된다.14)Zhao 등15)은 산화로 인한 디아세틸레이션 반응을 개선하기 위해 DMAP, 아세트산 나트륨, 황산 촉매를 사용하여 리그닌의 에스테르화 반응을 향상시켰다. 이처럼 리그닌의 반응성을 높이기 위해 다양한 방법이 접목되고 있다.
초음파 처리는 분산 현상 및 나노 입자 제조를 위한 공정처리로 널리 이용되고 있다. 초음파 처리시 강한 압축력과 감압력에 의해 미세 증기 기포가 형성 및 붕괴되면서 순간적으로 고온의 에너지와 압력이 방출되는 공동현상이 발생하게 되는데, 이는 화학 구조 절단을 야기하여 저분자량의 셀룰로오스 유도체나 리그닌 중합체 생성이 가능하다.16) 따라서 초음파 처리를 통해 리그닌의 반응성을 높인 후 아세틸화를 진행하면 에너지 소비 및 반응시간을 단축할 수 있을 것으로 예상한다.
이에 본 연구에서는 초음파 처리를 응용하여 크라프트 리그닌의 아세틸화 반응에 접목하고자 하였으며, 초음파 전처리를 통한 입자크기 조절로 리그닌 반응성 향상에 기인한 반응 시간 및 효율 등 최적조건을 탐색하고자 하였다. 또한, 적외선 분광분석의 특정 피크를 활용하여 리그닌 아세틸화의 치환도를 분석해 효율성을 평가하였다.
2. 재료 및 방법
2.1 공시재료
본 연구에서는 리그닌의 아세틸화 반응을 위하여 Sigma-Aldrich (St. Louis, MO, USA)에서 Mw = 10,000 g/mol 크라프트 리그닌(Kraft lignin, KL)을 구매하여 사용하였다. 실험에 사용된 시약으로 무수 아세트산(Acetic anhydride, 98%, Daejung Chemical CO., Ltd., Korea), 피리딘(pyridine, 99.8%, Duksan Chemical CO., Ltd., Korea)을 사용하였다.
2.2 실험방법
2.2.1 아세틸화 리그닌 제조
리그닌 수산기에 아세틸기를 치환하여 아세틸화 리그닌 (acetylated lignin, AL)을 제조하였다. 제조 시 반응시간을 4, 8, 12, 24, 48 시간으로 상이하게 하여 Table 1의 조건으로 진행하였다. KL 1 g에 무수아세트산과 피리딘을 각각 40 mL씩 첨가하여 상온에서 교반 하였다. 반응 후 아세틸화 용액은 400 mL 증류수에 응집방지를 위해 한 방울씩 적하하여 침전시켰으며, 반응열을 식혀주기 위하여 상온에서 약 2시간 가량 방치하였다. 이후 공극 직경 40–50 µm의 깔대기형 글라스 필터(glass filter funnel)를 이용하여 침전물을 여과한 뒤 원심분리를 통해 증류수로 3회 이상 세척을 진행하였다. 최종적으로 24시간 동안 45°C 오븐에서 건조하여 파우더 형태의 AL을 얻었고, 각 리그닌 샘플의 무게를 재어 반응 시간에 따른 수율을 비교하였다.
Table 1.
Acetylation conditions of KL
| Sample |
Kraft lignin (g) |
Acetic anhydride (mL) |
Pyridine (mL) |
Temperature (°C) |
Reaction time (h) |
| AL4 | 1 | 40 | 40 | Room Temperature | 4 |
| AL8 | 8 | ||||
| AL12 | 12 | ||||
| AL24 | 24 | ||||
| AL48 | 48 |
Table 2.
Ultrasonication conditions for kraft lignin
| Sample |
Ultrasonic energy (KHz) |
Solid to liquid ratio (w/w) |
Amplitude power (%) |
Temperature (°C) |
Reaction time (min) |
| UsL15 | 20 | 1:100 | 70 | 10 | 15 |
| UsL30 | 30 | ||||
| UsL60 | 60 | ||||
| UsL120 | 120 |
2.2.2 크라프트 리그닌의 초음파 처리
리그닌 아세틸화 반응 전 초음파 처리에 따른 반응 효율성을 알아보고자 했으며, 초음파 처리는 프로브 타입의 초음파 장치(1,500W Ultrasonic Processor, VCX-1500, USA)를 사용하였고, 에탄올에 KL을 첨가하여 1% 농도의 용액을 제조하여 진행하였다. 초음파 처리 시간은 15, 30, 60, 120분을 각각 적용하여 Table 2의 조건으로 초음파처리를 수행하였으며, 초음파 처리에 의한 온도 상승으로 리그닌 분자의 재중합을 방지하기 위해 칠러를 이용하여 10°C에서 초음파 처리를 진행하였다. 이후 초음파 처리된 리그닌을 글라스필터(GF/C)에 여과시킨 후 45°C 오븐에 건조하였다.
2.3 리그닌 입자 특성
초음파 처리에 의한 입자형태 분석을 위해 주사 전자 현미경(Scanning Electron Microscopy, FE-SEM, JEOL ltd., Japan)을 이용하여 관찰하였다. SEM 측정 직전 파우더 상태의 리그닌을 60초간 백금(platinum, Pt) 코팅하였으며, 가압전압은 5 kV로 수행되었다. 입도는 입도분석기(Particle Size Analyzer; Analysette 22 MicroTec plus, Fritsch GmbH, Germany)를 사용하여 측정하였다.
2.4 적외선분광스펙트럼을 통한 아세틸화 효율성 분석
적외선분광스펙트럼(Attenuated Total internal Reflection-Infrared spectrometer, ATR-IR, NiCOLET-iS10, Thermoscientific, United States) 분석 시 측정영역은 4000–400 cm-1, 측정 간격은 4 cm-1, 32 scans이었으며, 측정이 완료된 IR 스펙트럼 데이터는 베이스라인 보정을 실시하였다. 모든 데이터는 최소 5회 이상 반복 측정한 후 평균한 값을 사용하였다. 또한, 리그닌 아세틸화 효율성은 지방족 아세틸기(‑C=O)에 해당하는 1741 cm-1 영역의 intensity와 방향족 아세틸기(‑C–O)에 해당하는 1200 cm-1 영역의 intensity 그리고 리그닌의 주요 구조를 나타내는 방향족 skeletal vibration의 특징적인 파장 중 하나인 1510 cm-1 영역의 intensity를 통하여 Eq. 1, Eq. 2에 따라 계산하였다.11) 추가로 수산기에 치환된 아세틸기 함량을 분석하기 위해 수산기(‑OH)에 해당하는 3300 cm-1 영역의 intensity와 리그닌 구조를 나타내는 1510 cm-1(reference)을 통해 Eq. 3에 따라 계산하였다. 이는 AL 샘플에 대해 아세틸 그룹에 의한 하이드록실 그룹의 치환 정도(Degree of substitution, DS) 지표를 나타낸다.
3. 결과 및 고찰
3.1 AL 특성
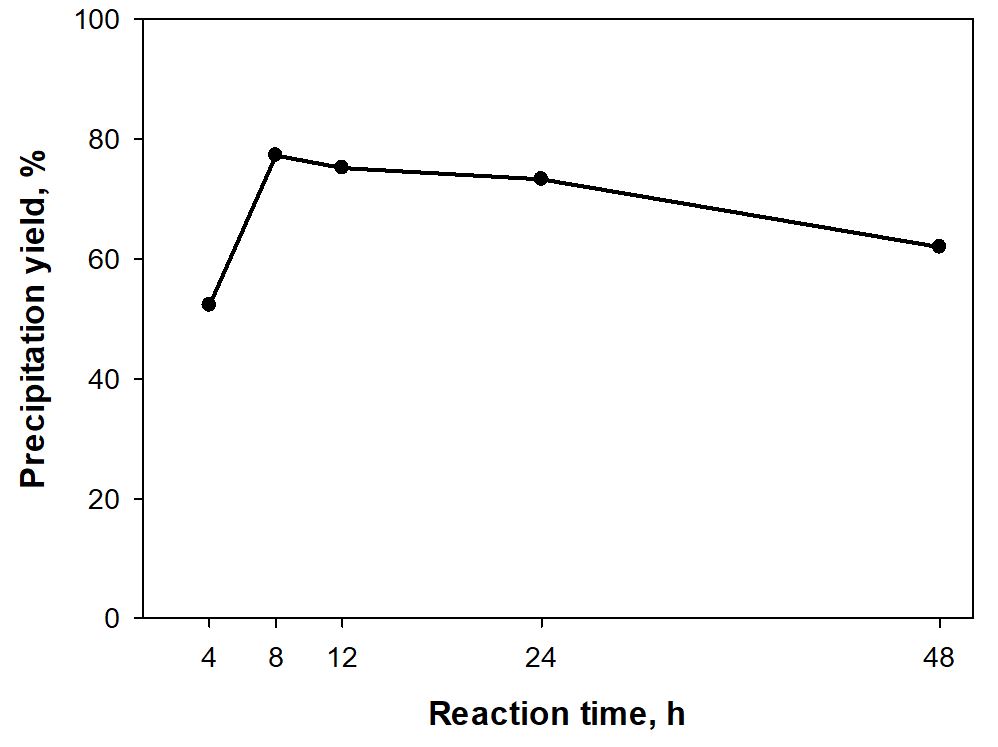
아세틸화 반응 시간에 따라 제조된 AL의 수율 변화를 Fig. 1에 나타냈다. 반응시간이 8시간 일 때 77.3%로 가장 높은 값을 나타냈으며, 그 이후에는 반응 시간이 증가할수록 감소하는 경향을 보였고, 48시간 반응 시 62%를 나타냈다. 또한 반응시간이 4시간 일 때 52.3%로 가장 낮은 수율을 보였다. 용매에 리그닌이 충분히 용해되었을 때 리그닌에 아세틸기가 합성되고 이에 따라 침전물의 수율이 증가하게 되는데 반응시간 8시간이 가장 적합한 것으로 판단되었으며, 해당조건 이하에서는 충분한 용해가 이루어지지 않아 미 반응 리그닌이 증가하여 아세틸화 반응 된 침전물의 양이 적어지는 것으로 판단된다.
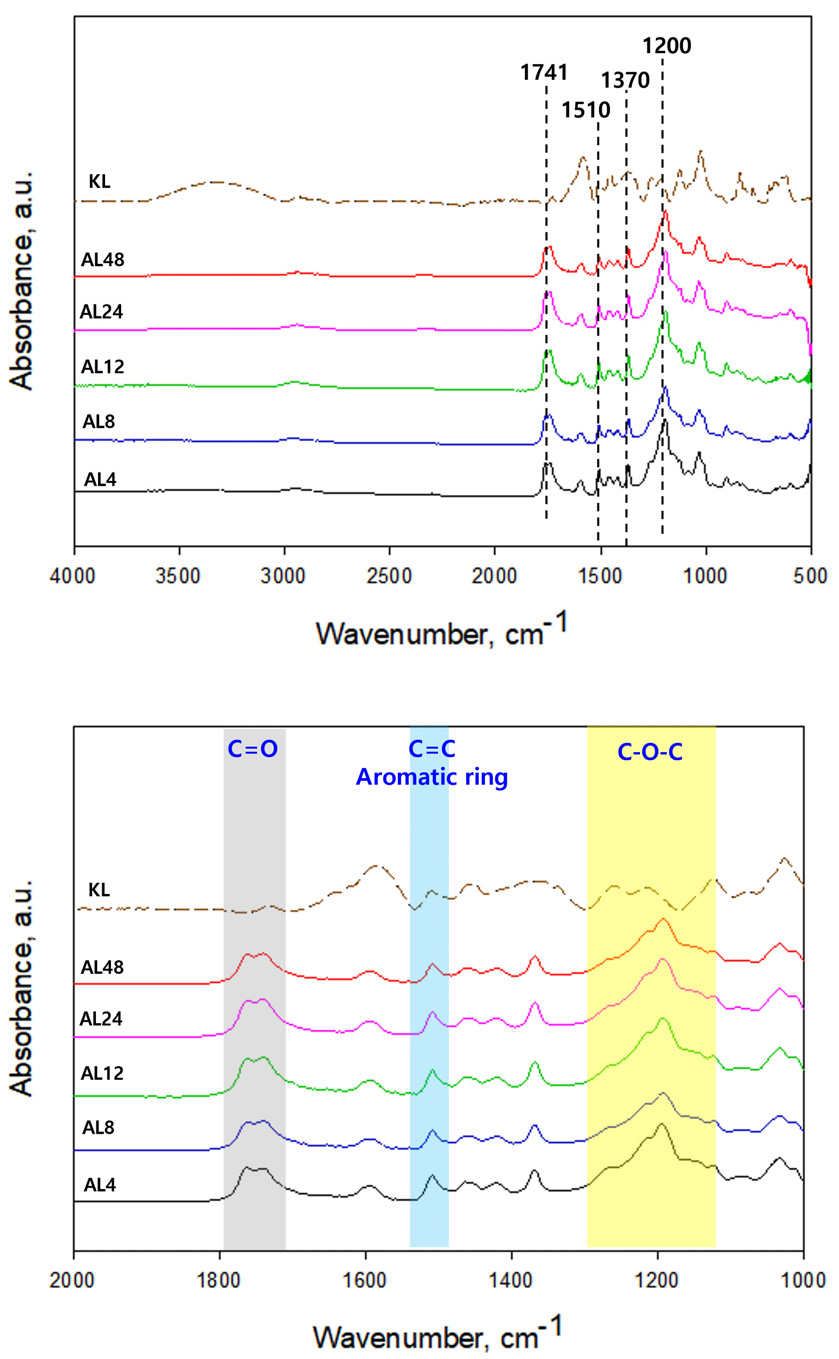
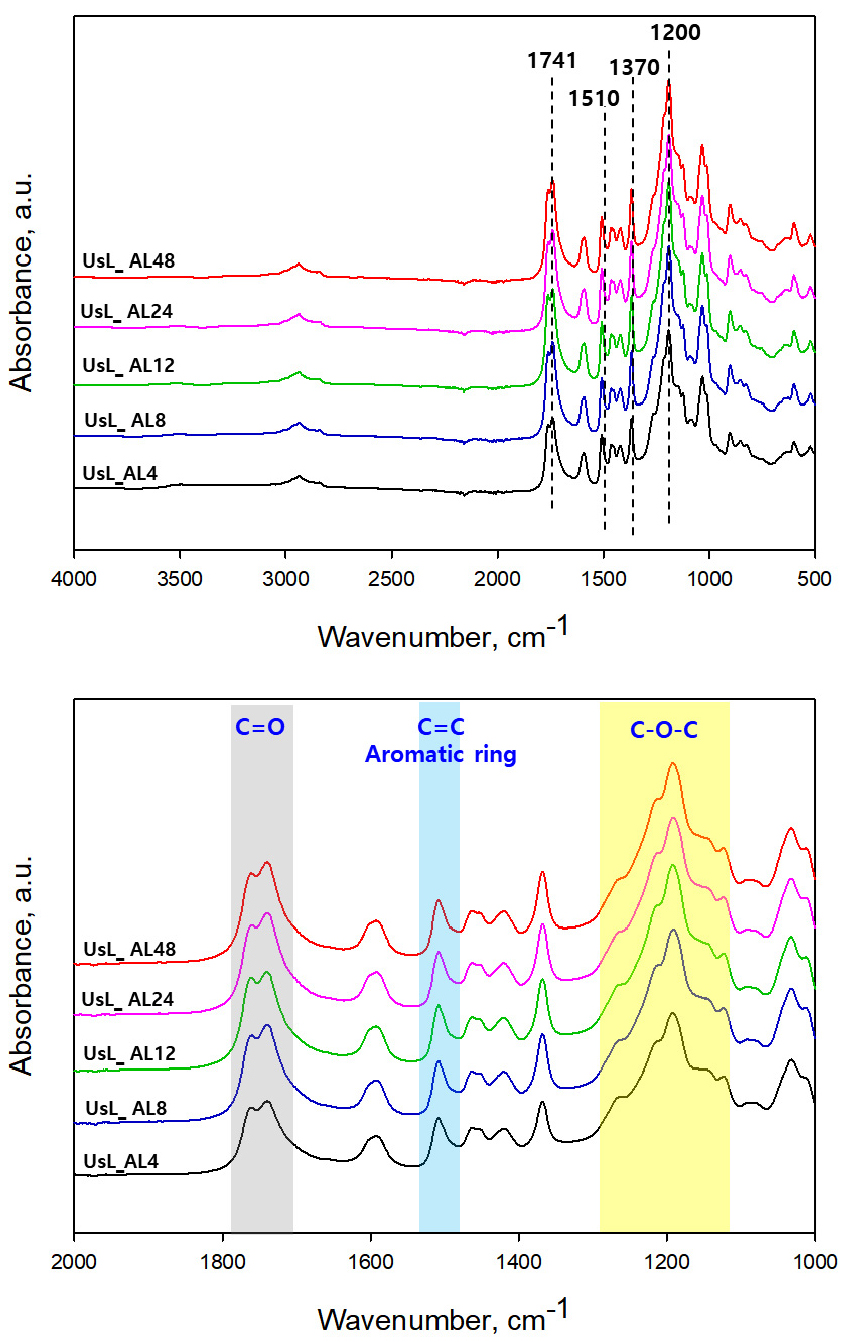
Fig. 2는 KL과 AL의 IR스펙트럼 그래프로 아세틸화 처리된 리그닌의 화학적 특성을 보여준다. AL에서는 C=O 지방족 아세틸기, C–O–C 방향족 아세틸 그룹에 해당하는 1741 cm-1, 1200 cm-1 파장대의 새로운 피크가 형성되었으며, 이를 통해 리그닌 아세틸화 반응이 성공적으로 이루어졌음을 확인하였다. 리그닌의 주요 구조인 방향족 skeleton vibrations을 나타내는 1510 cm-1 파장대의 피크는 변하지 않았으며 이는 아세틸화 반응이 진행되는 동안 리그닌의 구조가 유지된다는 것을 의미한다.
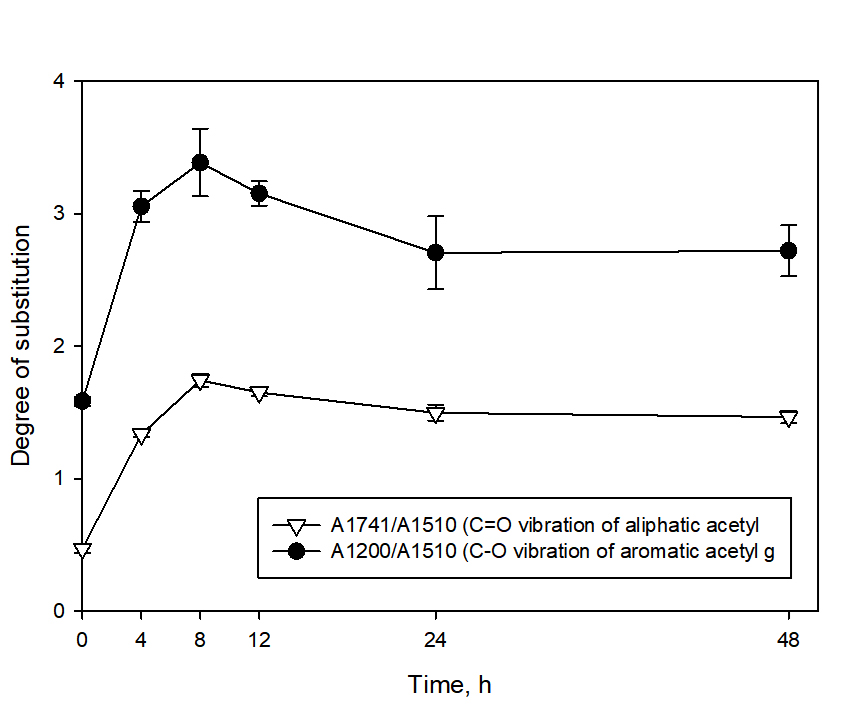
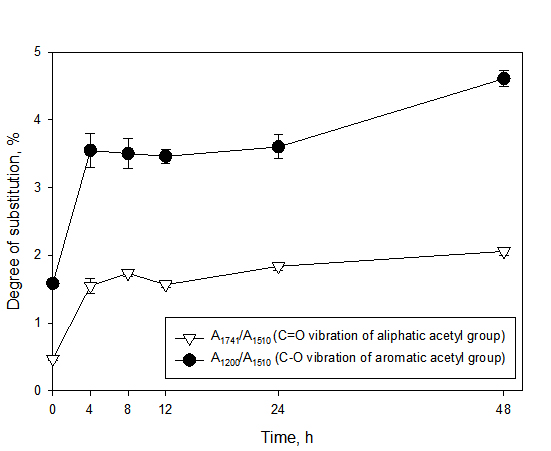
반응시간에 따른 아세틸기의 치환 정도를 정량화 하기 위한 척도로 IR 스펙트럼 데이터를 통해 치환도(DS)를 측정하였으며, 그 결과를 Fig. 3에 나타냈다. 리그닌의 아세틸화는 지방족 및 방향족 수산기에서 모두 발생하지만 반응시간에 관계없이 방향족 수산기 아세틸기의 치환도가 훨씬 높은 것을 확인할 수 있다. 이는 상대적으로 방향족 수산기의 pKa값이 낮아 아세틸화 반응 시 더 쉽게 탈양성자화 되고, 촉매 및 염기로 작용하는 피리딘에 의해 방향족 수산기의 친핵성을 더욱 증가시켜 아세틸화 반응이 잘 발생하게 된다.17)
전체적으로 반응시간 8시간 까지는 치환도가 크게 증가한 것을 확인할 수 있었으며, 8시간 반응 조건에서 A1741/A1510, A1200/1510의 DS가 1.74, 3.38으로 가장 큰 값을 나타냈다. 이는 아세틸화가 빠르게 진행되었으며 비교적 쉽게 변형될 수 있는 수산기가 아세틸기로 먼저 치환되는 반응에서 기인한 것으로 사료된다. 수율 결과(Fig. 1)와 더불어 봤을 때, 피리딘 촉매 하에 무수아세트산을 이용해 아세틸화를 진행할 시 8시간 반응이 가장 효율적인 것을 확인하였다. 8시간 이상의 반응에서는 치환도가 감소하는 경향을 보였는데, 이는 반응시간이 길어지면서 아세틸기가 결합되는 정반응보다 리그닌 구조의 에스터 결합이 절단되는 역반응이 더 우세하게 진행되기 때문이라고 판단된다.14)
3.2 초음파 전처리에 따른 리그닌 입자 특성
3.2.1 리그닌 입도 변화
Table 3은 초음파 전처리 시간에 따른 KL의 입도를 나타낸 결과이다. 측정된 결과에서 D10, D50, D90은 입자 크기 분포를 설명하는 지표로서 각각 누적 입도분포를 의미한다. 즉, 전체 입자량을 100으로 봤을 때 D10의 경우에는 누적 입도 분포의 10%에 해당하는 입도 값을 의미한다. 또한 D [4,3]은 입자의 체적으로부터 산출한 평균 직경을 의미한다.
Table 3.
Particle size distribution of KL with ultrasonication treatment time
|
D 10 (µm) |
D 50 (µm) |
D 90 (µm) |
D [4,3] (µm) | |
| UsL15 | 1.6 | 10.3 | 70.3 | 22.8 |
| UsL30 | 1.6 | 9.5 | 64.3 | 21.5 |
| UsL60 | 1.4 | 7.4 | 34.5 | 13.9 |
| UsL120 | 1.4 | 7.7 | 32.3 | 13.1 |
초음파 처리시간이 증가함에 따라 리그닌 입도는 점차 감소하는 것으로 확인되었다. 특히 초음파처리 60분에서는 입도가 급격하게 감소했으며 D [4,3]도 동일한 경향을 보이는 것을 확인할 수 있었다. 이는 초음파처리 적용에 따른 공동현상으로 인해 미세 기포를 생성하고 입도의 분해를 촉진하기 때문이라고 사료된다.18) 하지만 60분 초과의 초음파 처리는 입도 감소에 큰 변화를 나타내지 않았다. 이에 따라 60분의 초음파 처리가 입도 조절에 따른 리그닌 반응성 향상에 가장 적합한 처리시간이라고 판단되어 아세틸화 반응에 적용하였다.
3.2.2 형태적 특성
Fig. 4은 KL의 초음파 처리 시간에 따른 리그닌 입자 형태의 변화를 나타낸 FE-SEM 분석 결과이다. 초음파 처리하지 않은 KL(Fig. 4a)의 경우 비교적 매끈한 표면과 구형의 과립 형태를 띄는 것을 관찰할 수 있었고, 초음파 처리 시간이 증가함에 따라 리그닌 입자의 크기가 작아지는 경향을 보였다. 하지만 상업용 KL과 비교하였을 때, 불규칙한 입자형태를 보였으며 초음파 처리 시에도 균일한 입자 형태를 얻을 수 있는 추가적인 방안이 필요한 것으로 판단된다.
3.2.3 화학적 특성
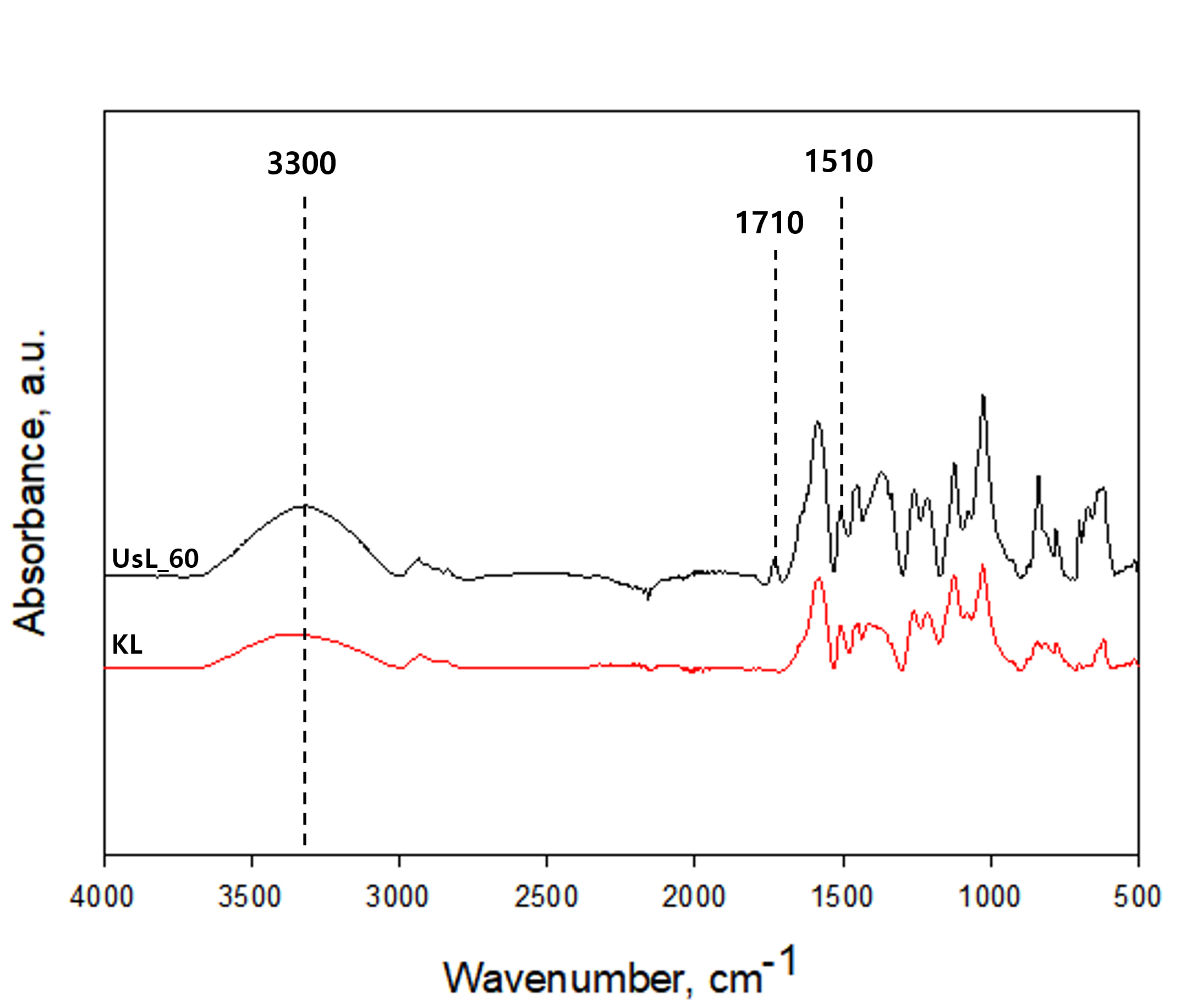
Fig. 5는 KL과 UsL60 리그닌의 IR 스펙트럼 데이터로 초음파 처리에 따른 화학적 특성을 보여준다. 전체적으로 초음파 처리 후 주요 피크의 강도가 증가하였고, 피크의 이동이나 새로운 피크 형성과 같은 변화는 관찰되지 않았다. 수산기에 해당하는 3300 cm-1 영역은 초음파 처리 후 피크 강도가 증가하였으며, 이는 초음파 처리 공정이 리그닌의 부분 산화를 유도하여 더 많은 수산기가 노출되기 때문이라고 사료된다.19) 카르보닐 및 카르복실기에서 C=O stretching에 해당되는 1710 cm-1 영역은 초음파 처리 후 피크가 뚜렷하게 증가하였는데, 이는 초음파 과정 중 형성될 수 있는 카르복실산 분자 내 수소결합에 의해 기인될 수 있다.20) 1510 cm-1 영역은 초음파 처리 전 후 리그닌 모두에서 비슷한 강도로 관찰되었고, 이는 해당 조건의 초음파 처리 과정이 리그닌의 방향족성에 영향을 미치지 않는다는 것을 나타낸다. 그러나, 1710 cm-1 영역의 피크 증가 및 주요 피크 강도의 증가를 고려할 때, 60분 초음파 전처리는 리그닌의 내부 구조 변화를 유도하여 반응성에 영향을 미쳤을 가능성이 있다고 판단된다.
3.3 초음파 전처리에 따른 리그닌 아세틸화 반응 특성 및 효율성 평가
Fig. 6은 반응 시간에 따른 아세틸화 UsL의 IR 스펙트럼을 나타낸 결과이다. 반응시간이 증가할수록 지방족 아세틸기와 방향족 아세틸 그룹에 해당하는 1741 cm-1, 1200 cm-1 파장대가 증가하는 것을 확인할 수 있다. 반면 리그닌의 주요 구조를 나타내는 1510 cm-1 파장대의 피크는 변하지 않아, 초음파처리 여부와 관계없이 아세틸화 반응동안 리그닌의 주요 구조가 유지됨을 의미한다.
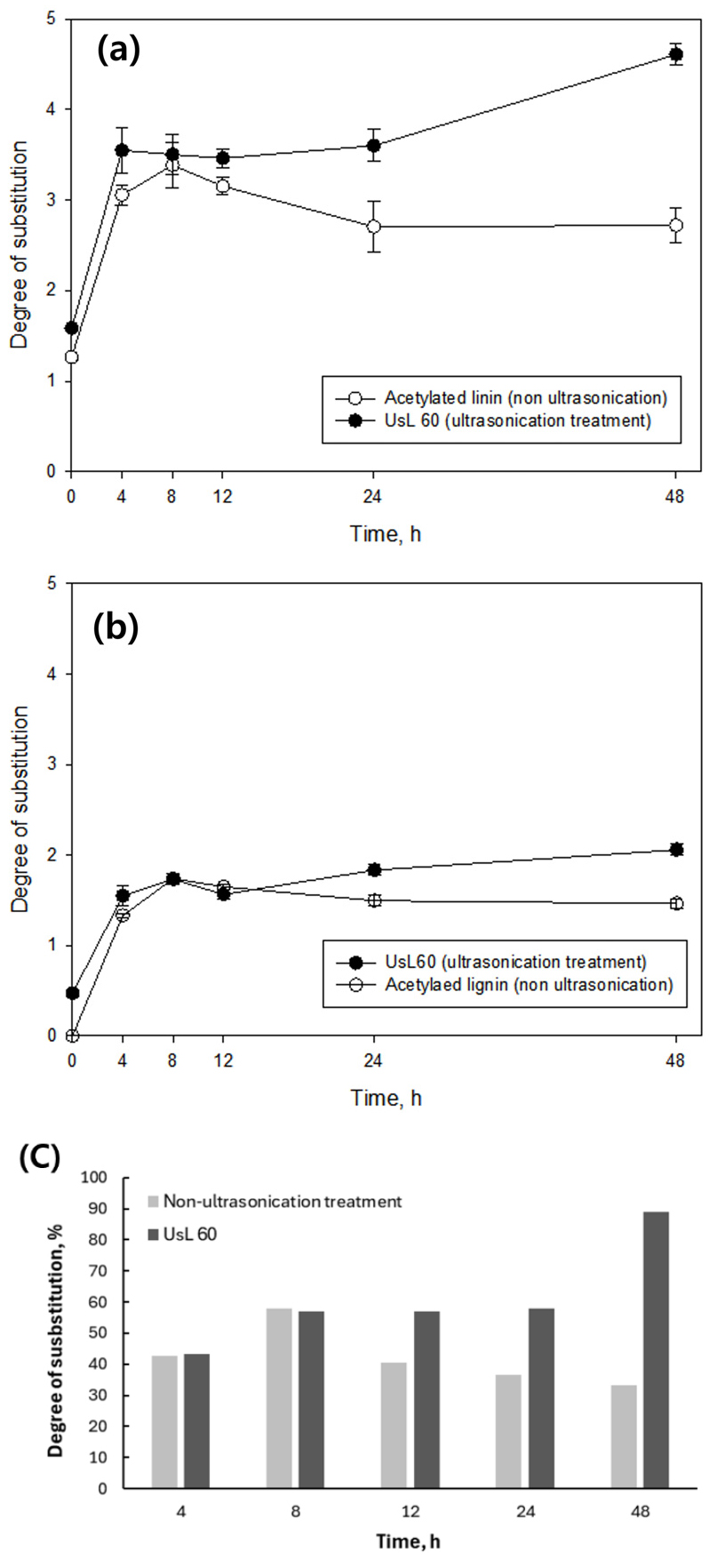
Fig. 7, 8은 초음파 처리에 따른 DS 값을 나타낸 결과이다. 반응시간 8시간까지는 초음파 미처리와 전처리에 따른 아세틸화 리그닌의 DS값이 비슷한 것으로 나타났다. 일반적으로 리그닌의 아세틸화 초기 반응에서는 접근이 용이한 ‑OH 그룹이 우선적으로 변형된다. 이에 따라 반응 시간 8시간까지는 표면 ‑OH 그룹과의 반응이 포화 상태에 도달했기 때문에 초음파 전처리 시에도 DS 값이 크게 변화하지 않는 것으로 사료된다. 짧은 반응 시간내로 치환도를 증가시키기 위해서는 반응 온도, 반응 시약의 첨가 비율을 조정하는 등의 추가적인 반응 조건 최적화가 필요한 것으로 판단된다.
초음파 미처리 조건에서는 반응시간 8시간 이후 DS가 감소한 반면, 초음파 전처리가 적용된 리그닌의 경우 8시간 반응 이후에도 DS값이 지속적으로 증가하여 48시간 반응 조건에서 A1200/A1510, A1751/A1510의 DS 값이 각각 2.05, 4.60으로 측정되었다. 초음파 전처리 시, SEM 이미지 분석을 통해 확인할 수 있듯이 리그닌의 미세 입자 형성과 미세한 균열을 유도하게 된다. 이러한 구조적 변화는 장시간 아세틸화 반응 시 내부로의 시약 침투를 촉진하여 아세트산 무수물과 리그닌 입자 간의 접촉을 증가시키고 반응 속도를 향상시키는 역할을 한다.14,18) 그 결과, 8시간 이후부터는 정방향 아세틸화 반응이 탈아세틸화 반응보다 우세하게 진행되어 DS가 크게 증가한 것으로 판단된다.
Fig. 8c는 리그닌 OH 단위 당 아세틸화 된 부위의 평균 값을 %로 나타낸 결과이다. 초음파 미처리 AL의 경우 34–58% 범위의 치환도 값을 보인 반면, 초음파 처리된 AL은 43–89%로 미처리 AL 보다 더 높은 치환도 값을 보였다. 특히 초음파 처리 AL은 12시간 반응 이후부터 미처리 AL보다 높은 치환도를 보였으며, 48시간 반응 조건에서는 89%로 가장 높은 DS 값을 기록했다. 따라서 리그닌의 초음파 전처리는 긴 아세틸화 반응 시간에서도 아세틸화 반응 속도를 증가시켜 역반응이 억제되고, DS가 증가하여 아세틸화 반응의 효율성을 향상시킬 수 있음을 보여준다.
4. 결 론
본 연구에서는 초음파 전처리가 리그닌 아세틸화 반응에 미치는 영향을 평가하였다. IR 분석을 통해 리그닌의 아세틸화가 성공적으로 진행되었다는 것을 확인하였고, 아세틸 그룹을 나타내는 특정 파장대의 피크를 통해 치환도 값을 도출했다. 초음파 미처리 시, 지방족 및 방향족 아세틸기에 해당되는 치환도가 1.71, 3.38로 나타났으며, 아세틸화 반응 8시간 이후로는 에테르 결합이 절단되는 역반응이 우세하여 치환도가 감소하는 경향을 보였다. 초음파 처리를 통하여 리그닌의 입자 크기가 감소하고 표면적이 증가하는 것을 확인하였고, 이는 아세틸화 반응 시 치환도의 증가로 이어졌다. 특히 미처리 리그닌과 다르게 8시간 반응 이후 긴 반응시간에서도 치환도가 증가하는 것을 확인하였고, 지방족 및 방향족 아세틸기의 최대 치환도가 2.05, 4.6으로 약 36.1%, 17.8% 증가하였다. 따라서 장시간의 리그닌 아세틸화 반응 시 초음파 전처리가 반응 효율성을 향상시키는데 있어 효과적임을 확인할 수 있으며, 촉매나 추가적인 화학적 처리 없이 환경 친화적이고 비용 효율적이므로 산업적 응용에 활용성을 높이는 계기가 될 수 있을 것으로 사료된다.