1. 서 론
키토산은 갑각류의 껍질, 곰팡이, 및 효모의 세포벽에서 추출한 천연 다당류로, 키틴을 탈아세틸화하여 얻어진다.1) 키토산은 의약품, 의료 용도, 섬유, 화장품, 식품 첨가제, 폐수 처리용 흡착제, 중금속 흡착제, 제지 등 다양한 분야에서 사용되고 있다.2) 과거에는 키토산의 원료 공급이 제한적이고, 추출 및 정제 기술이 미비하여 생산 비용이 높고 탈아세틸화 정도가 일정하지 않아 키토산의 특성이 일관되지 않았다.3) 그러나 최근 키토산의 생산 및 정제 기술이 발전하면서 키토산의 공급이 증가하고, 응용 분야도 더욱 넓어지고 있다.4)
최근의 수질 오염을 정화하기 위한 흡착제들은 높은 비용과 비생분해성으로 회수 및 처리 과정이 필수적이다.5) 이러한 문제를 해결하기 위해 천연 고분자를 흡착제로 사용하는 연구가 증가하는 추세이다.6) 천연 고분자 중 키토산은 자연에서 얻을 수 있는 천연 고분자 자원으로, 비용 효율성과 선택적 오염물질 제거 능력으로 인해 주목받고 있다.7) 또한 키토산은 아미노기(–NH2)와 수산기(–OH)를 포함한 화학적 구조로 항산화 특성을 지니고 있어 의약품, 식품 보존 및 포장재 분야에서도 널리 활용되고 있다.8)
키토산의 아미노기는 알데하이드와의 친핵성 첨가 반응으로 Schiff 염기를 형성한다. 이 과정을 통해 제조된 Schiff 염기 유도체는 키토산이 가진 고유의 기능성을 향상시킬 수 있다.9) Schiff 염기는 탄소와 질소의 이중결합인 이민기(C=N)를 가진 유기 화합물로, 반응성이 좋은 아미노기에 결합하는 화합물의 특성에 따라 다양한 특성을 부여할 수 있다. 예를 들어 페놀성 수산기를 포함한 알데하이드를 도입하여 제조된 Schiff 염기 유도체는 활성산소 및 자유 라디칼의 형성을 억제하는 강한 항산화 특성을 갖게 된다.10) 이렇듯 Schiff 염기는 반응성, 항산화성, 및 항균성으로 인해 다양한 분야에서 응용되고 있는데, 주로 반응 촉매, 센서, 의약품, 약물 전달 시스템, 및 공업 분야에서 사용되고 있다.11)
본 연구에서는 키토산 고유의 기능인 항산화성 및 흡착 특성을 향상하고자 키토산의 아미노기를 통해 Schiff 염기 반응을 수행하여 페놀성 수산기를 포함한 알데하이드를 도입한 Chitosan-based Schiff base (CSB) 유도체를 제조하였다. CSB의 물리·화학 구조 분석, 흡착 특성 및 항산화 특성을 평가하였다. 제조된 CSB의 항산화 특성은 2,2-diphenyl-1-picrylhydrazyl (DPPH)를 이용한 Radical scavenging activity (RSA) 및 IC50 값을 통해 평가하였고, 염료 흡착 특성은 양이온성 염료인 Methylene blue (MB)와 음이온성 염료인 Methyl orange (MO)를 사용하여 분석하였다. 두 염료 중 흡착량이 우수한 음이온성 염료를 사용하여 CSB를 이용한 흡착 공정의 최적 조건을 탐구하고자 흡착제의 투입량, pH, 반응 시간을 달리하여 음이온성 염료와 흡착량을 분석하였다. 또한 농도 및 시간 변화에 따른 흡착 등온선 분석 및 흡착 동역학 분석을 통해 CSB의 흡착 메커니즘을 연구하였다.
2. 재료 및 방법
2.1 공시재료
Low molecular weight chitosan (Mw=50,000), deuterium oxide (99.8%), acetic acid-d4 (≥99.5%), sodium chloride (99.5%), 2,2-diphenyl-1-picrylhydrazyl (DPPH) (95%), Methylene blue (MB) (97%), Methyl orange (MO) (85%)는 Sigma-Aldrich로부터 구입하였다. Acetic acid (99.7%), ethyl alcohol (94.5%), 0.1 N-sodium hydroxide solution, methyl alcohol (99.5%), 및 0.1 N-hydrochloric acid solution은 Daejung chemical & metals (Korea)로부터 구입하였고, 3,4-dihydroxybenzaldehyde는 Tokyo Chemical Industry로부터 구입하였다. 모든 화학 시약은 추가 정제 없이 사용하였다.
2.2 실험방법
2.2.1 키토산 기반 Schiff-base (Chitosan Schiff base, CSB) 유도체 제조
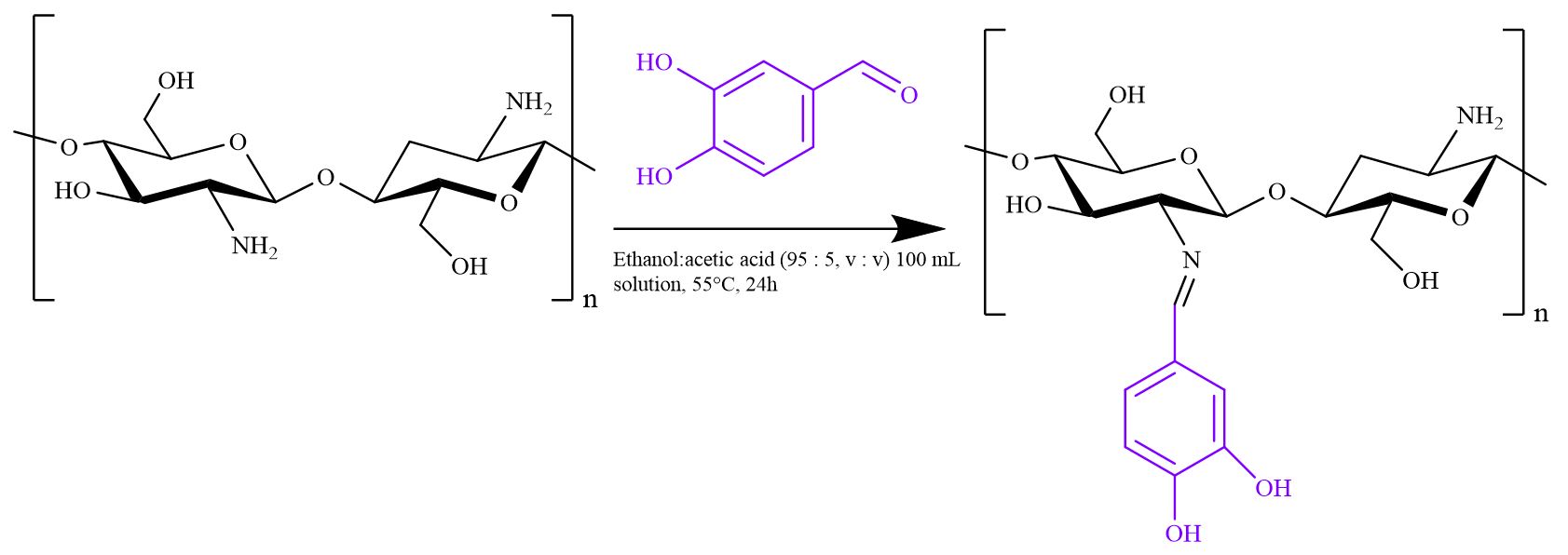
Fig. 1에 제시된 방법으로 CSB를 합성하였다. 키토산(1.0 g)을 ethanol : acetic acid (95 : 5, v/v) 100 mL 혼합물에 용해한 후 자석 교반기를 이용하여 350 rpm의 속도로 30분 동안 혼합하였다. 이후 3,4-dihydroxybenzaldehyde (2.0 g)를 천천히 첨가하였고, 55°C에서 24시간 동안 반응시켰다. 합성된 샘플은 미반응 물질을 제거하기 위해 ethanol을 사용하여 원심분리기로 5,000 rpm, 5분 동안 5회 이상 세척하였다. 세척 후 남아있는 ethanol을 증발시키기 위해 55°C 오븐에서 24시간 동안 건조하여 CSB를 얻었다.
2.2.2 CSB의 물리·화학적 특성 분석
키토산 및 CSB의 화학적 구조를 파악하기 위해 attenuated total reflectance (ATR)가 장착된 Fourier Transform Infrared (FT-IR) spectroscopy (IR Tracer-100, Shimadzu, Japan)를 이용하여 분석하였다. 분석 조건은 4000–500 cm-1 범위의 파수에서 64회 scans로 수행하였다. 1H Nuclear Magnetic Resonance Spectroscopy (NMR) (Bruker Avance Neo 600, Germany) 분석은 키토산 및 CSB 시료 10 mg을 acetic acid-d4 : deuterium oxide (1 : 60, v/v) 1 mL 혼합물에 용해했고, 512회 scans를 수행하였다. CSB 표면의 원소 함량을 분석하기 위해 Thermo Scientific (U.K) 사의 K Alpha+ 모델을 이용하여 X-ray Photoelectron Spectroscope (XPS) 분석을 진행하였다. 조사 범위는 400 µm를 150 eV의 pass energy로 분석하였고 5 scans, 20 ms 체류 시간으로 수행하였다. 키토산 및 CSB의 원소 함량을 파악하기 위해 Elemental analysis (EA) 분석을 진행하였고, He, O2로 이루어진 촉매 가스를 950°C에서 시료와 순간적인 연소 방식으로 GC Column (2m and 6X4mm Porapack QS 50–80 mesh)을 통해 H, C, N, S의 원소를 분석하였다.
키토산 및 CSB의 표면전하를 탐구하기 위해 제타 전위(Zetasizer NanoS instrument Malvern Instruments, UK)를 다음과 같은 방법으로 분석하였다. 0.001 M NaCl 용액 100 mL에 각각 0.025 g의 키토산 및 CSB를 용액에 분산시켰다.12) 용액의 pH는 3–12의 범위로 적정하였고, pH 적정은 0.1 N HCl 및 0.1 N NaOH 용액을 사용하였다.
키토산과 CSB의 결정성을 파악하기 위해 Cu Ka 방사선을 이용한 X-ray diffraction (XRD) (X’pert-pro MPD, PANalytical, Netherlands)를 사용하여 키토산과 CSB의 결정화도를 분석하였다.
키토산과 CSB의 비표면적의 변화를 비교하기 위해 Brunauer-Emmett-Teller (BET) 분석을 진행하였다. BET 분석은 Microtrac BEL (BELSORP MAX X)을 사용하였고, 완전히 건조된 샘플 시료 1 g 을 액체 질소로 냉각된 Dewar에서 샘플을 77 K에서 80시간 동안 유지하면서 수행하였다.
2.2.3 CSB의 치환율 (degree of substitution, DS) 분석
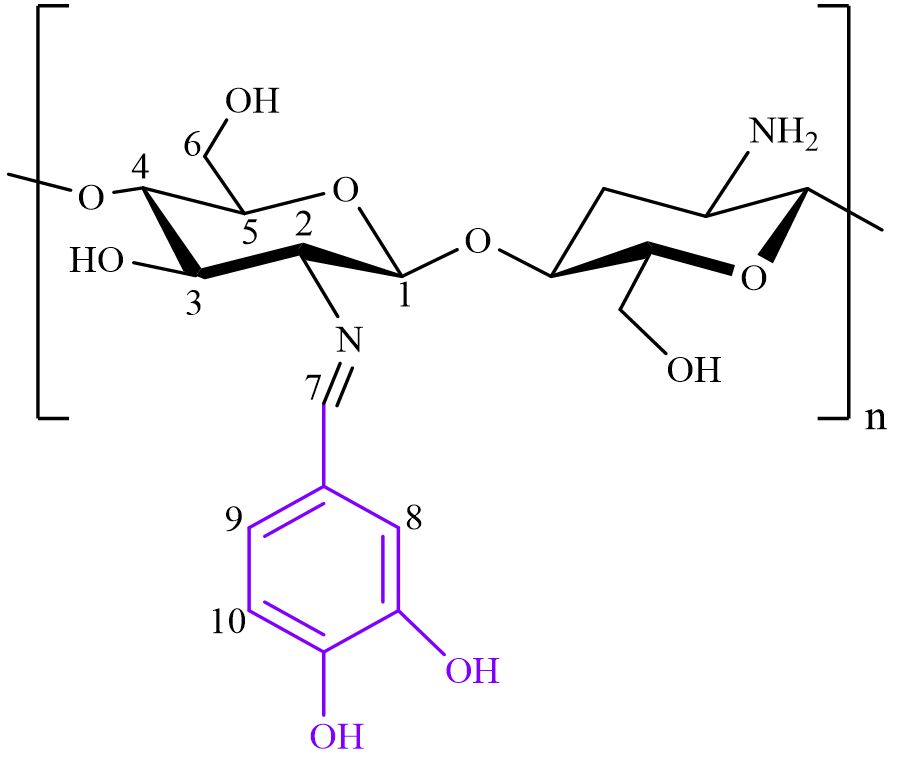
제조한 CSB의 이민기 치환율을 계산하였다. 치환율을 산출한 방법은 1H NMR 분석을 통해 Fig. 1에 나타난 2번 및 7번 수소 영역의 적분값을 Eq. [1]을 사용하여 계산하였다.13)이와 같은 방법으로 다양한 실험 조건에서 제조된 CSB의 치환율을 계산하여 CSB의 최적 반응 조건을 도출하였다.
여기서 Aimine은 Fig. 2의 7번 이민기의 수소 영역의 적분값을 의미하고, AH-2는 Fig. 2의 2번 피라노스 링의 수소 영역의 적분값을 의미한다.
2.2.4 CSB의 결정성 분석
키토산과 CSB의 결정성을 평가하기 위해 XRD 분석을 수행하였다. XRD 분석 결과를 통해 키토산 및 CSB의 결정화도(Crystallinity Index, CI)를 Eq. [2]를 사용하여 산출하였다.14) 결정화도는 결정 구조를 형성하는 입자들이 얼마나 균일하게 정렬되어 있는지를 나타내는 지표로, 이 값이 클수록 물질 내의 입자들이 더 균일하게 배열되어 있으며, 더 강한 결정 구조를 나타낸다.
여기서 Imax는 키토산과 CSB의 최대 강도 피크가 있는 영역의 적분값을 의미하고, Iam은 키토산 및 CSB의 비정질 탄소(Amorphous Carbon Intensity, 2θ = 10–16°) 영역의 적분값을 의미한다.
2.2.5 CSB의 항산화 특성 분석
항산화 특성을 평가하기 위해 키토산과 CSB를 대상으로 DPPH를 이용한 항산화 특성 분석 실험을 진행하였다. 키토산은 아미노기와 수산기를 포함하고 있으며, CSB는 이민기와 페놀성 수산기를 가지고 있어 자유 라디칼과 반응하여 이를 중화시키는 항산화 특성을 나타낸다.15) 이러한 이유로 항산화 특성을 평가하기 위해 다양한 농도(0.0025–1.5 mg/mL)의 키토산 및 CSB 샘플들을 distilled water : acetic acid (98 : 2, v/v) 2 mL에 용해한 후, DPPH methanolic solution (0.2 mM) 2 mL 및 methanol 5 mL를 첨가하여 혼합물을 제조하였다.16) 혼합물은 실온에서 30분 동안 200 rpm의 속도로 진탕 배양기에서 반응시켰다. 반응 후 샘플들은 UV-Vis spectroscopy (UV-2550, Shimadzu, Japan)를 사용하여 517 nm에서 흡광도를 측정하였다. RSA의 백분율은 Eq. [3]을 사용하여 계산하였다.
여기서 Abscontrol은 시료가 없는 샘플의 흡광도를 의미하고, Abssample은 키토산 및 CSB 샘플의 흡광도를 의미한다.
2.2.6 CSB의 염료 흡착 특성 분석
CSB의 염료 흡착 특성을 평가하기 위해 음이온성 및 양이온성 염료를 사용하여 실험을 진행하였다. 염료 수용액(400 mg/L) 25 mL에 CSB를 첨가한 후, 각각의 MB (661 nm) 및 MO (471 nm)의 흡광도를 UV-Vis spectroscopy를 이용해 측정하였다. 측정된 흡광도를 Eq. [4] 및 [5]에 대입하여 흡착량(qe) 및 흡착 효율(E)을 계산하였다. 최적의 염료 흡착 조건을 찾기 위해 CSB의 투입량, 반응 시간, pH를 다양하게 조절하여 실험을 수행하였으며, pH의 조절은 0.1 N NaOH 및 HCl 용액을 사용하여 전체 농도에 큰 영향을 미치지 않도록 하였다.
여기서 Ci와 Cf는 각각 초기 및 반응 후 염료 농도(mg/L)를 의미하고, V는 염료 용액의 부피(L), M은 흡착제의 양(g)을 의미한다.
2.2.7 CSB의 흡착 등온선 분석
흡착 등온선은 일정한 온도에서 흡착제 표면에 흡착되는 물질의 양과 평형 농도 사이의 관계를 나타내는 곡선으로, 이를 통해 흡착 메커니즘을 분석할 수 있다. 본 연구에서는 CSB의 흡착 등온선을 분석하기 위해 CSB 10 mg을 투입하고, 염료 용액의 pH를 4로 조절한 후 60분 동안 반응시켰다. 농도가 다른 염료 용액 25 mL (100–1,000 mg/L)에 대해 흡착 실험을 수행하였다. 실험 결과를 분석하기 위해 Langmuir 및 Freundlich 흡착 등온선 모델을 적용하였다.
여기서 Eq. [6] 및 [7]의 qe는 흡착제의 단위 질량당 흡착된 물질의 양(mg/g)을 의미하며, qm은 최대 흡착량(mg/g), Ce는 평형 상태에서의 흡착물 농도(mg/L), KL은 Langmuir 상수, KF와 n은 Freundlich 상수를 나타낸다.
2.2.8 CSB의 흡착 동역학 분석
흡착 동역학은 흡착 과정의 속도와 메커니즘을 해석하는 방법으로, 대표적인 흡착 동역학 모델로는 pseudo-first-order kinetic 및 pseudo-second-order kinetic 모델이 있다.17) 본 연구에서는 CSB의 흡착 동역학 분석을 위해 CSB 10 mg을 사용하고, 염료 용액의 pH를 4로 조정한 후 염료 용액 25 mL (400 mg/L)를 반응 시간(0–60분)에 따라 실험을 진행하였다. 실험 결과를 분석하기 위해 pseudo-first-order kinetic 및 pseudo-second-order kinetic 흡착 동역학 모델을 적용하였다. 흡착 동역학 분석의 식은 다음과 같다.
여기서 Eq. [8] 및 [9]의 qt는 반응 시간 t에서의 흡착량(mg/g), qe는 평형 상태에서 흡착제 단위 질량당 흡착된 양(mg/g), t는 시간(분)을 의미하고 K1, K2는 각각 1차 및 2차 반응 속도 상수(g/mg․min)를 의미한다.
3. 결과 및 고찰
3.1 CSB의 물리·화학적 특성 분석
3.1.1 CSB의 degree of substitution (DS) 분석
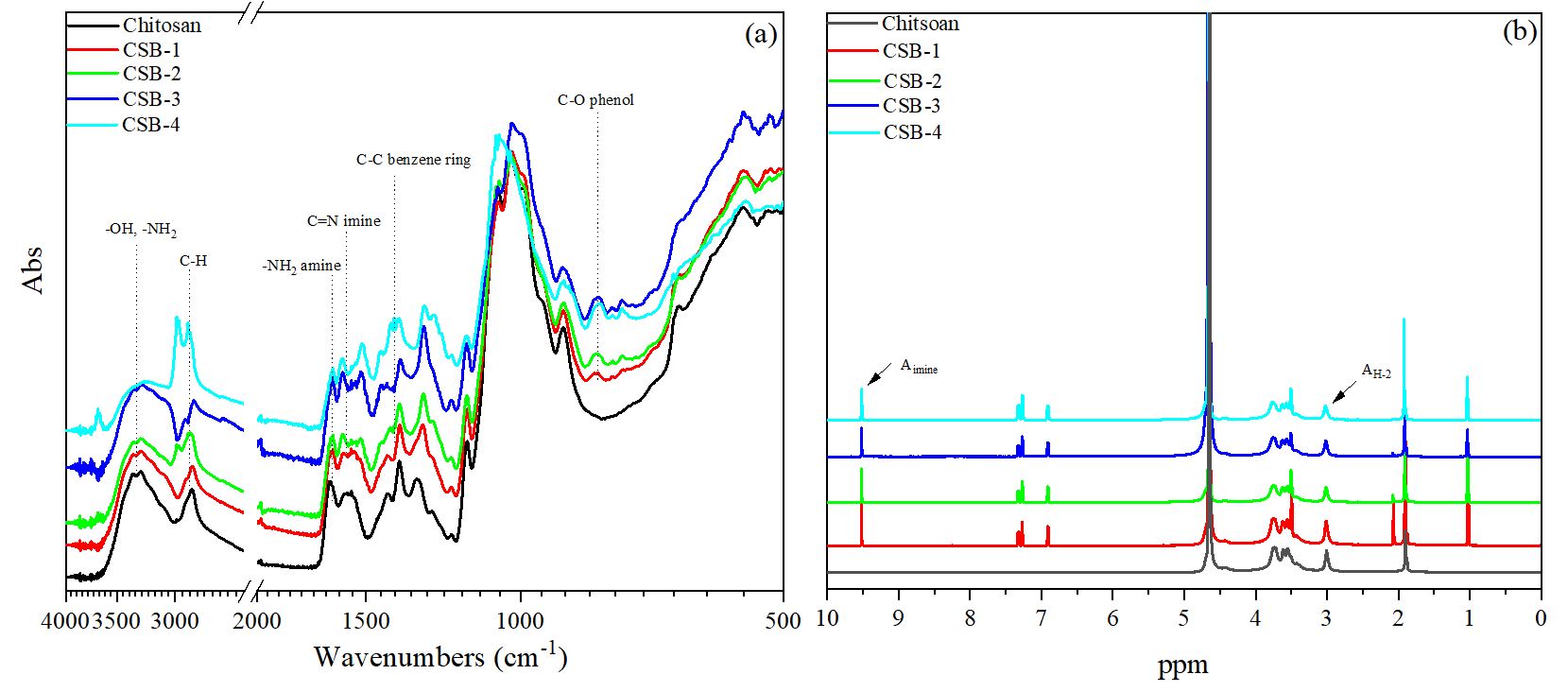
CSB의 최적 제조 조건을 탐색하기 위해 페놀성 수산기를 포함한 알데하이드 시약의 투입량과 pH를 달리하여 실험을 진행하였으며, 조건 및 결과는 Table 1 및 Fig. 3에 나타내었다. Fig. 3에 나타난 조건별 CSB 샘플들의 FT-IR 및 1H NMR 결과에서 페놀성 수산기의 도입으로 인한 방향족 고리의 피크(1450–1600 cm-1, 6.0–8.0 ppm) 및 이민기의 피크(1630 cm-1, 9.6 ppm)를 확인하였다. 또한, 형성된 이민기의 치환율을 계산하고자 제조된 CSB 샘플들의 1H NMR 분석을 통해 각각의 수소가 차지하는 적분값을 Eq. [1]에 따라 이민기의 치환율을 계산하였다.
Table 1.
Synthesis conditions for CSB samples
먼저 페놀성 수산기를 포함한 알데하이드 시약의 투입량 변화 조건에서는 투입량이 증가함에 따라 치환율도 증가하였으며, 2.0 g에서 치환율은 18.02%로 가장 높았다. pH 조건에서는 산도가 높아질수록 치환율이 증가하는 경향을 보였다. 이러한 결과는 Schiff base 반응이 pH에 크게 영향을 받으며, 환경에 따라 반응 메커니즘 속도가 결정되는 특성에 기인한 것으로 판단된다.18) 이와 같은 실험을 통해 CSB 제조의 최적 조건은 시약의 투입량 2.0 g, pH 3.90, 반응 온도 55°C로 결정되었다.
3.1.2 CSB의 화학적 구조 분석
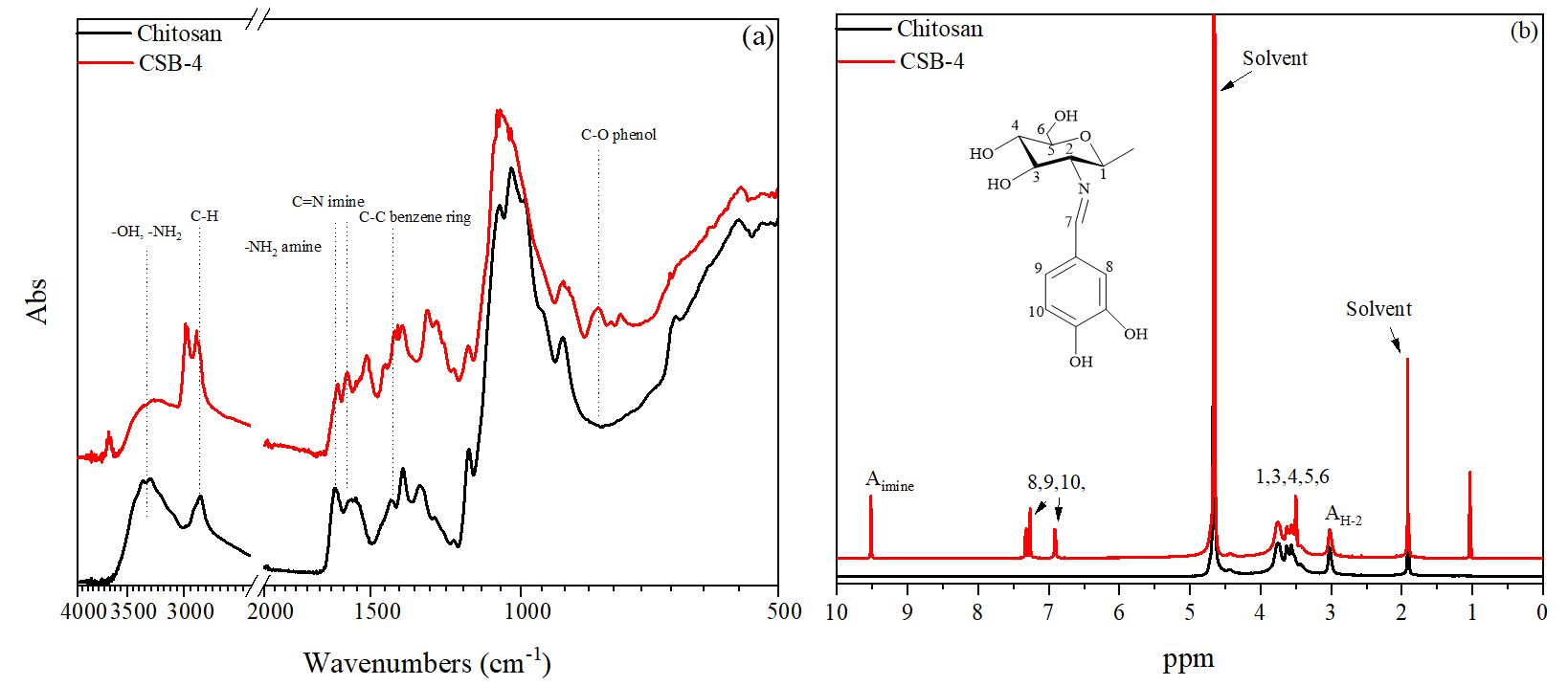
FT-IR 분광 스펙트럼을 이용하여 키토산과 CSB-4의 화학적 구조를 분석하였다. 키토산과 CSB-4의 FT-IR 분석 결과는 Fig. 4a에 나타나 있다. 키토산의 화학적 구조로 인해 –OH 및 –NH2 피크는 3300 cm-1에서 관찰되었다. 키토산의 탄화수소 결합은 2800 cm-1에서, 아마이드 및 –NH2 피크는 1650 cm-1에서 확인되었다.19) 페놀성 수산기를 도입한 CSB-4의 경우, Schiff base의 이민 그룹(C=N)은 1630 cm-1에서 나타났다.20)추가로 키토산과 비교했을 때 CSB-4에서는 1498 cm-1, 756 cm-1 및 1273 cm-1에서 새로운 피크들이 관찰되었는데, 이는 페놀의 –C–O 신축 진동 피크, 방향족 알데하이드기의 –C–C 결합의 신장 및 굴절 진동 피크에 해당한다.
Fig. 4b는 키토산과 CSB-4의 1H NMR 분석 결과를 보여준다. CSB-4는 키토산과는 확연히 다른 피크를 보였다. 먼저 1.9–2.0 ppm 피크에서는 키토산의 H-Acetyl과 NMR 용매 피크(acetic acid-d4)가 관찰되었다. 2.9–3.1 ppm에서는 키토산의 피라노스 링 H-2 피크가, 3.3–5.0 ppm에서는 키토산의 지방족 탄소 피크가 관찰되었다.21) CSB-4는 키토산의 화학적 구조로 인한 피크 외에도 페놀성 수산기의 도입으로 인한 방향족 고리의 6.0–8.0 ppm 피크와 Schiff base 반응으로 형성된 이민기의 9.6 ppm 피크를 보였다.22)
키토산과 CSB-4의 원소 분포 변화를 분석하기 위해 EA를 수행하였다. Table 2는 키토산과 CSB-4의 EA 분석 결과를 보여주며, Schiff base 반응 전과 반응 후 산소와 질소는 감소하였지만, 탄소와 수소는 증가하였다. 이는 키토산의 화학적 구조에 페놀성 수산기가 도입되면서 상대적으로 탄소와 수소가 증가하고 산소와 질소가 감소한 것으로 해석된다.23) FT-IR, 1H NMR, EA 분석을 통해 Schiff base 반응을 통해 페놀성 수산기가 성공적으로 도입되어 이민기가 형성되었음을 확인하였다.
Table 2.
Elemental content of chitosan and CSB-4
| Sample | Elemental content | |||
| C (%) | H (%) | N (%) | O (%) | |
| Chitosan | 41.63 | 7.02 | 7.40 | 43.95 |
| CSB-4 | 45.18 | 7.06 | 6.84 | 40.93 |
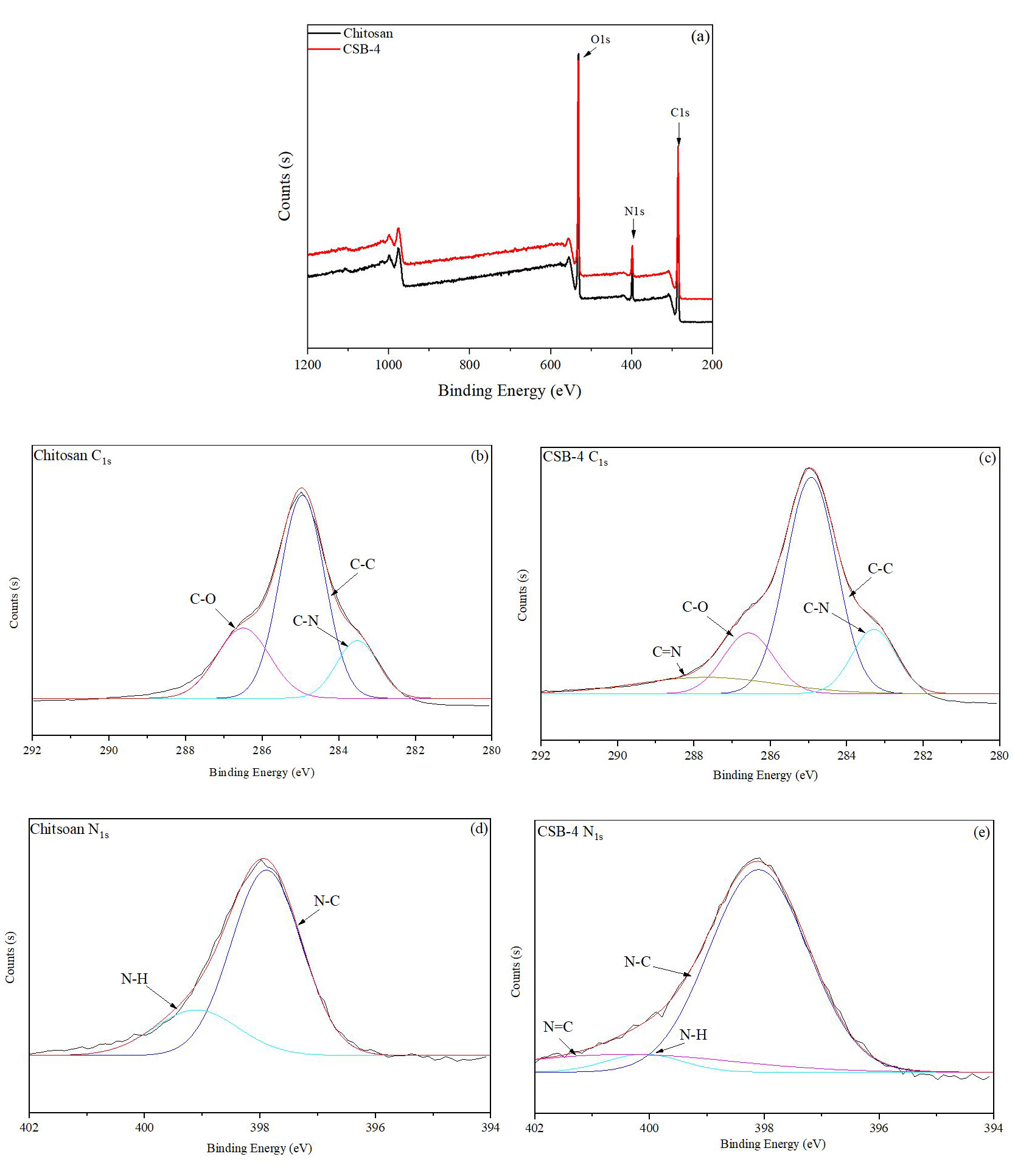
3.1.3 CSB의 XPS 분석
Fig. 5는 키토산과 CSB-4의 XPS 분석 결과를 나타내었다. 키토산과 CSB-4는 피크 강도의 차이가 뚜렷하게 나타났다. Fig. 5a에서 CSB-4의 탄소 피크가 전체적으로 키토산보다 더 크게 나타난 것을 확인하였다. 이는 페놀성 수산기가 도입됨으로써 탄소 함량이 증가한 것으로 예측된다. Fig. 5b와 5c는 키토산과 CSB-4의 탄소 피크를 확대한 XPS 결과를 보여주며, Fig. 5c에서는 CSB-4의 288.00 eV 근처에서 C=N 이민기의 피크가 확인되었다.24) 이민기의 존재는 질소의 확대 부분인 Fig. 5e의 401.66 eV 근처에서도 N=C 피크로 동일하게 나타났다. 따라서 XPS 분석을 통해 페놀성 수산기의 성공적인 도입으로 CSB-4에서 이민기가 형성되었음을 확인하였다.
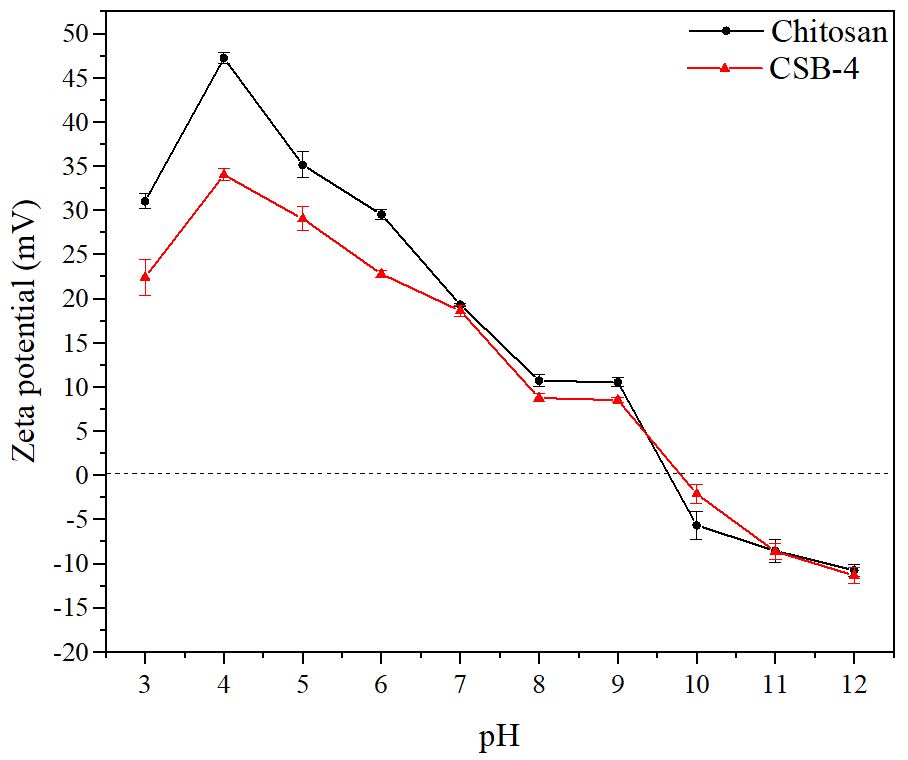
3.1.4 CSB의 제타 전위 분석
Fig. 6은 키토산과 CSB-4의 표면 전하를 분석한 제타 전위 결과를 나타내었다. 키토산과 CSB-4는 pH가 산성일 때 양전하를 띄는 것으로 나타났다. 이는 산성 환경에서 아미노기와 이민기가 양성자화되기 때문으로 판단하였다.25) 전반적으로 모든 pH 범위에서 CSB-4는 키토산보다 낮은 양전하 값을 보이며, 이는 CSB-4가 양이온성 키토산에 음이온성 페놀성 수산기가 추가됨으로써 양전하 값이 감소했기 때문으로 판단하였다.
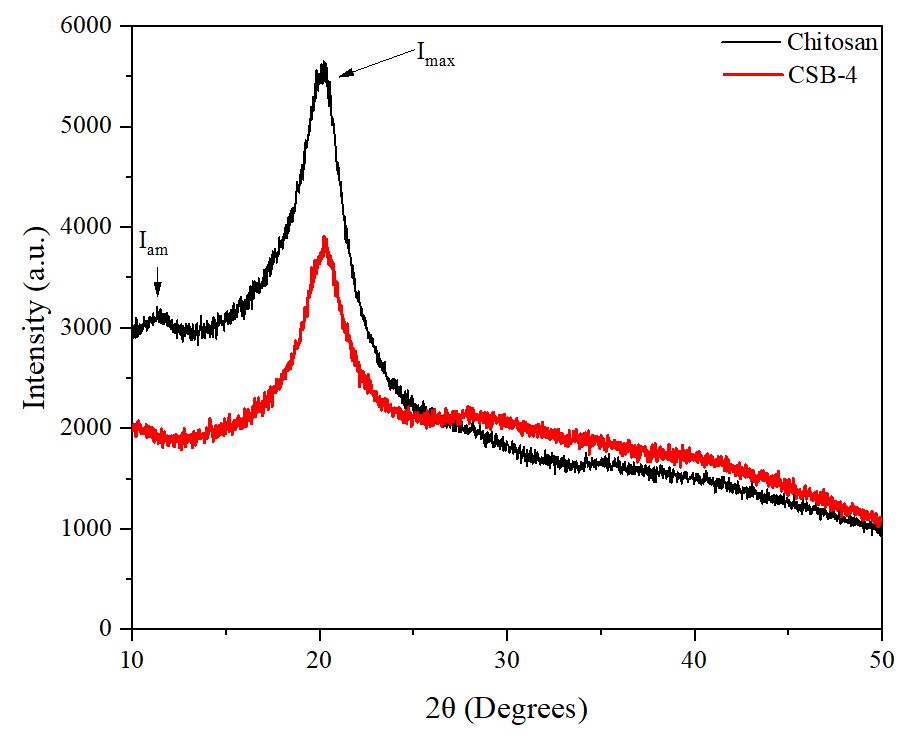
3.1.5 CSB의 결정성 분석
키토산과 CSB-4의 결정 구조를 분석하기 위해 XRD 분석을 수행하였다. Fig. 7은 이 분석의 결과를 보여준다. 키토산과 비교했을 때 CSB-4는 비정질 탄소 영역(Iam)의 피크가 감소한 것을 확인할 수 있었다. 이는 키토산이 페놀성 수산기와 결합하여 반응성이 높은 비정질 탄소가 줄어들었기 때문으로 해석된다.26) 또한 키토산과 CSB-4의 최대 강도 피크(Imax)에서도 키토산과 비교했을 때 감소가 나타났다. 이는 Schiff 염기 형성으로 인해 아미노기를 가진 키토산의 결정성 부분을 유지하고 있는 지방족 탄소의 수소 결합이 분해된 결과로 판단된다.27) XRD 분석 결과를 바탕으로 결정성 지수(CI)를 계산한 결과, 키토산은 69.17%, CSB-4는 63.79%로, 키토산에 비해 CSB-4의 CI가 감소했음을 확인할 수 있었다.
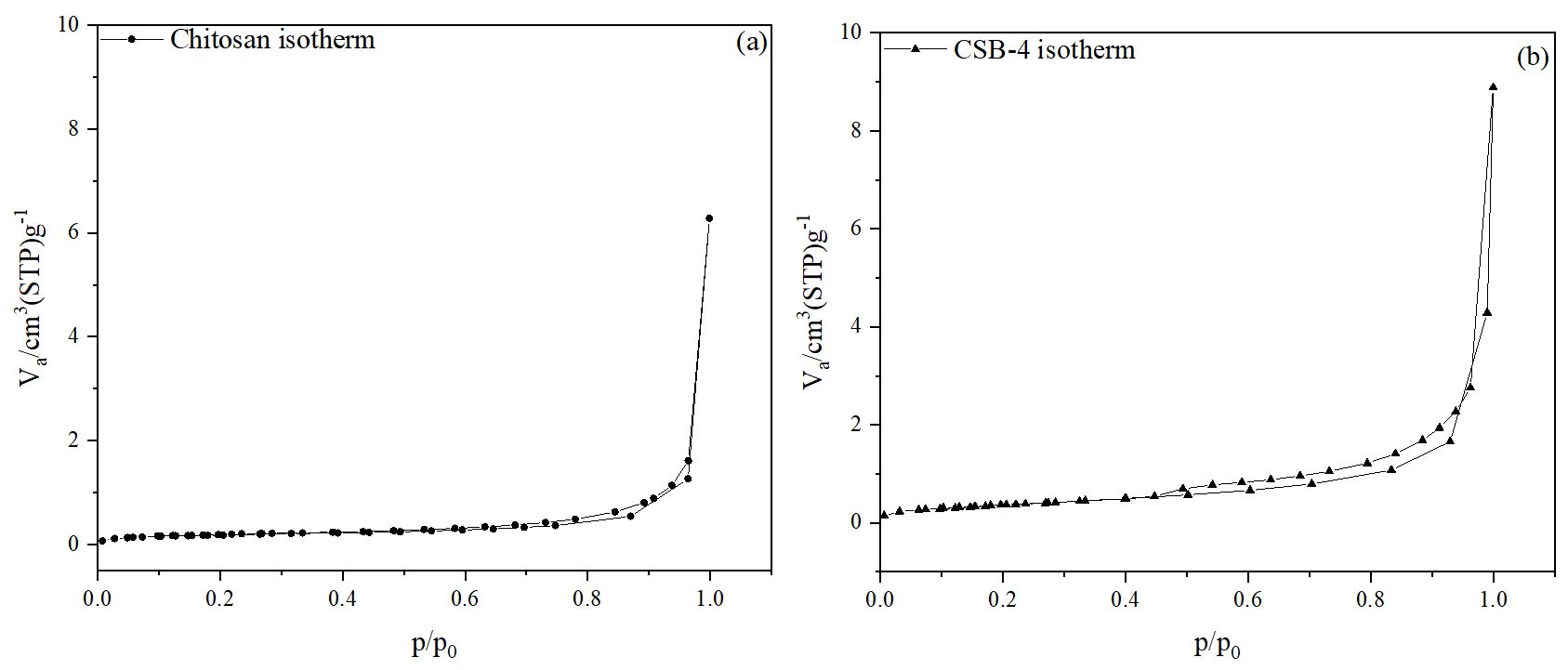
3.1.6 CSB의 BET 분석
키토산과 CSB-4의 비표면적 변화를 확인하기 위해 BET 분석을 진행하였으며, 실험 결과는 Fig. 8에 나타내었다. 그림 8a와 8b는 키토산과 CSB-4의 BET 등온선을 보여주며, 키토산과 비교했을 때 CSB-4의 비표면적이 더 크게 증가한 것을 확인할 수 있다. 또한 BET 흡착 등온선 그래프를 통해 키토산과 CSB-4의 비표면적을 계산한 결과, 키토산은 0.65 m2/g, CSB-4는 1.35 m2/g으로 약 2배 이상의 비표면적 증가가 나타났다. 이러한 결과는 페놀성 수산기의 도입으로 인한 π-π 상호작용 결합력 향상에 기인한 것으로 예측된다.28) 또한 BET 흡착 등온선 그래프의 형태를 통해 물질의 공극 특성을 추정할 수 있으며, Fig. 8a와 8b를 통해 키토산과 CSB-4의 그래프 곡선이 일치하지 않고 서로 다른 형태를 보이는 것으로 보아 다공성 소재인것으로 판단하였다.
3.1.7 CSB의 항산화 특성 분석
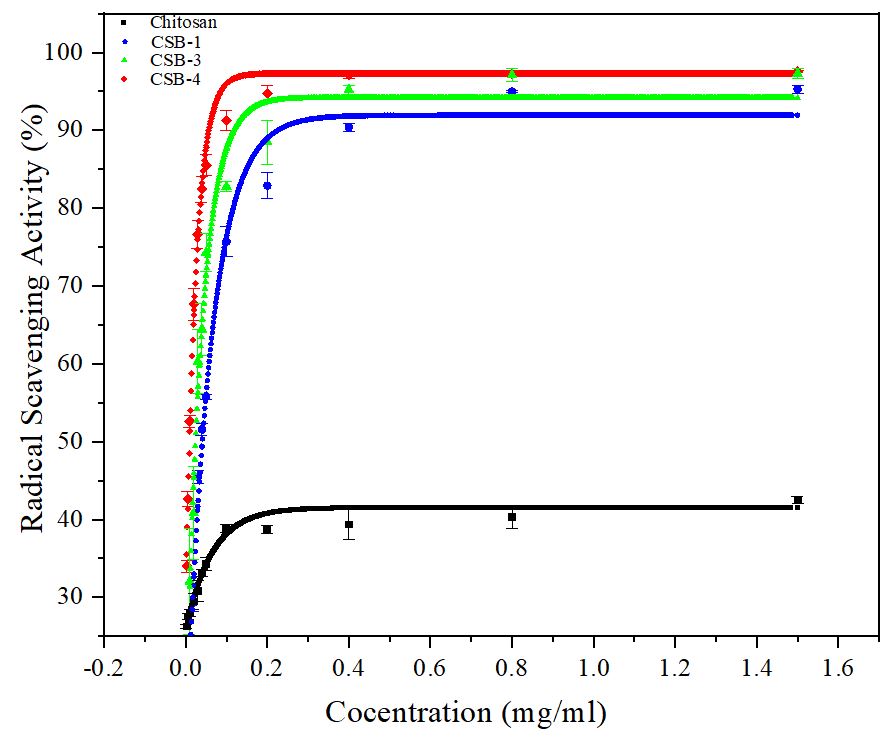
키토산과 다양한 치환율을 가진 CSB 샘플들의 항산화 특성을 분석하기 위해 DPPH를 이용한 실험 결과를 Fig. 9에 나타냈다. 그림 8에서 제작된 CSB 샘플들과 키토산을 비교한 결과, 모든 농도에서 CSB 샘플들의 RSA가 키토산보다 1.5배 이상 높게 나타났다. 이러한 RSA의 증가는 Schiff 염기의 페놀성 수산기가 성공적으로 도입된 결과로 해석된다.29) 또한, 치환율이 다른 CSB 샘플들을 실험한 결과, 치환율이 높을수록 RSA가 증가하는 것을 확인할 수 있었다. Table 3은 키토산, CSB-1, CSB-3 및 CSB-4의 치환율과 IC50값을 나열한 것으로, 이를 통해 CSB 샘플들의 항산화 특성이 키토산에 비해 크게 향상되었음을 확인할 수 있다.
Table 3.
Antioxidant activity results of CSB samples with different substitution degrees
| Sample | DS (%) | IC50 value (µg/mL) |
| Chitosan | Absent | 2,480 |
| CSB-1 | 10.53 | 39.6 |
| CSB-3 | 20.46 | 22.7 |
| CSB-4 | 30.54 | 9.4 |
3.1.8 CSB의 염료 흡착 특성 분석
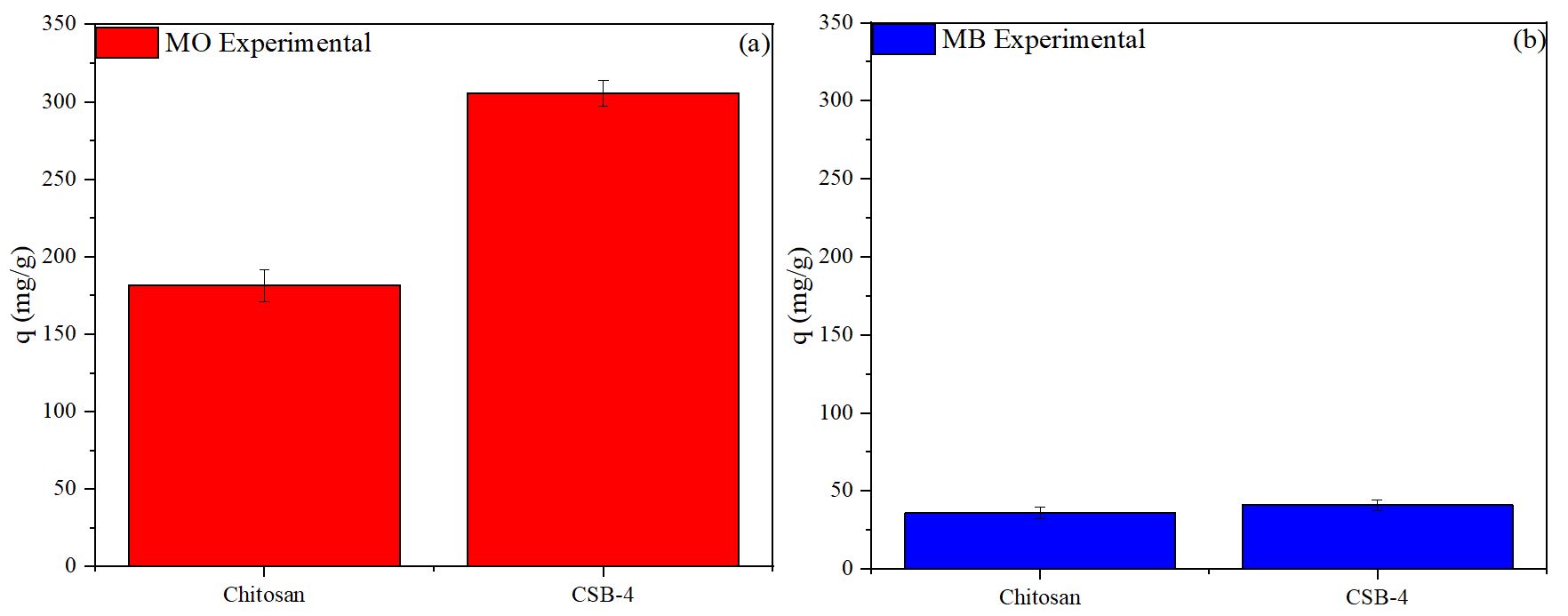
Table 4와 Fig. 10은 키토산과 CSB-4의 양이온성 및 음이온성 염료 흡착 실험 조건과 결과를 보여준다. 키토산과 CSB-4는 음이온성 염료인 MO에 대해 높은 흡착량을 나타낸 반면, 양이온성 염료인 MB에 대해서는 흡착량이 미미했다. 이러한 결과는 앞서 제타 분석 실험에서 확인된 것처럼 각 샘플들이 양전하 특성을 가지고 있어 음이온성 염료와 잘 흡착되었기 때문으로 해석된다. 특히, 음이온성 염료 흡착량에서 키토산과 CSB-4를 비교했을 때 CSB-4의 흡착량이 약 2배 증가한 것으로 나타났다. 이는 앞서 BET 분석 결과와 일치하며, 키토산의 개질 후 비표면적 증가와 페놀성 수산기의 도입으로 인한 π-π 상호작용 결합력 향상에 기인한 것으로 보인다.
Table 4.
Information on dye adsorption experiments with chitosan and CSB-4
| MB | MO | |||||
| Dosage (mg) | pH | Time (min) | Dosage (mg) | pH | Time (min) | |
| Chitosan | 10 | 7.53 | 30 | 10 | 6.48 | 30 |
| CSB-4 | 6.83 | 6.75 | ||||
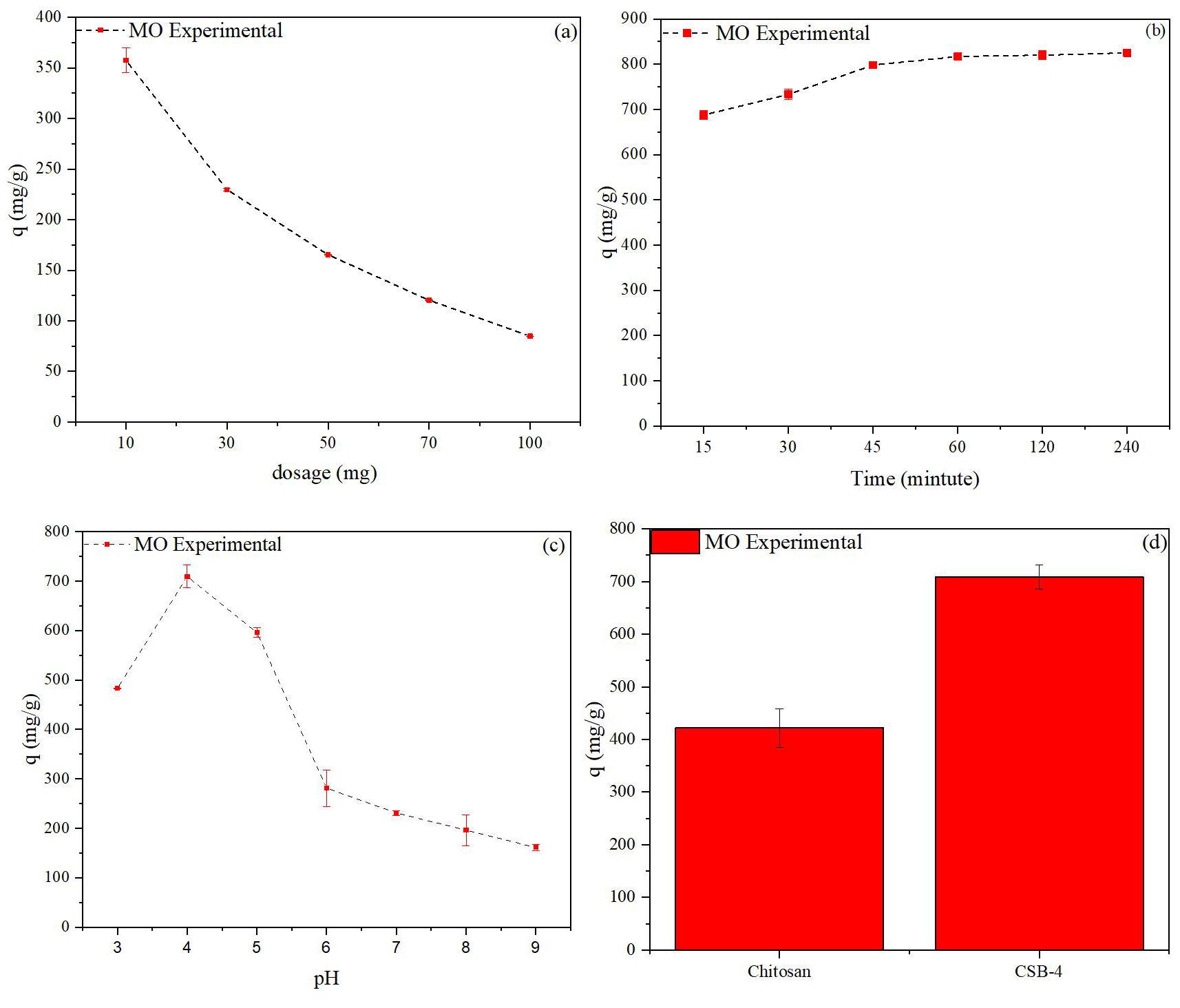
Fig. 11은 CSB-4와 음이온성 염료 간 최적 흡착 조건을 결정하기 위해 흡착제 투입량, 반응 시간, pH 변화에 따른 흡착량을 나타낸 그래프이다. 흡착제 투입량은 10 mg에서 최대가 되었고, 그 이상 투입 시 흡착량이 감소하는 경향을 보였다. 이러한 결과는 Eq. [4]에 따라 흡착량이 투입량 증가에 따라 감소한 것으로 해석된다. 따라서 이후 실험에서는 흡착제 투입량을 10 mg으로 고정하였다. Fig. 11b는 반응 시간에 따른 흡착량을 나타내며, 반응 초기부터 빠르게 유기 염료와 흡착이 일어나 60 분 까지 급격히 증가한 후 평형에 도달했다. Fig. 11c는 pH에 따른 CSB-4의 염료 흡착량을 보여주며, CSB-4는 pH 4에서 가장 높은 음이온성 염료 흡착량을 보였다. 이는 제타 분석 결과에서 CSB-4가 pH 4에서 가장 높은 양전하를 가진 것과 관련이 있다.
앞선 실험 결과를 바탕으로 음이온성 염료와 CSB-4의 최적 흡착 조건은 CSB-4 투입량 10 mg, 반응 시간 60 분, 염료 수용액의 pH 4로 결정되었다. Fig. 11d는 최적 조건에서 키토산과 CSB-4를 음이온성 염료와 흡착시킨 실험 결과로, 초기 Fig. 10a에서 진행한 실험 결과와 비교했을 때 음이온성 염료의 흡착량이 증가했음을 확인할 수 있었다.
3.1.9 CSB의 흡착 등온선 분석
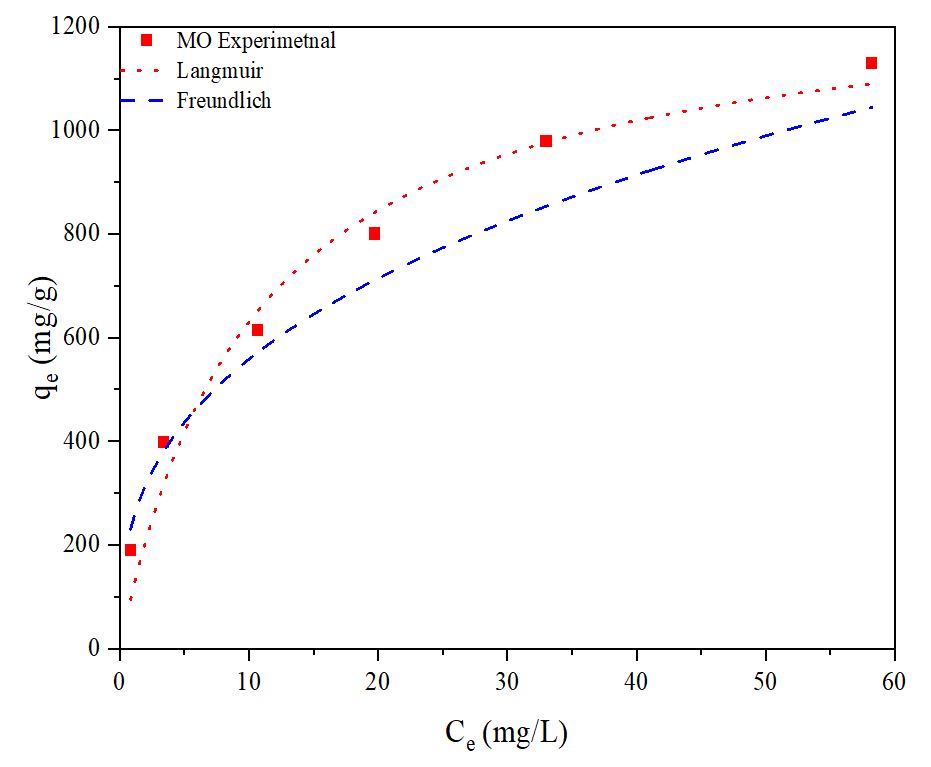
Fig. 12는 음이온성 염료와 CSB-4의 Langmuir 및 Freundlich 흡착 등온선 결과를 보여준다. Table 5의 R2 값을 보면, CSB-4는 Freundlich 모델보다 Langmuir 흡착 모델에 더 잘 맞는 것으로 확인되었다.30) 따라서 CSB-4는 유기 염료를 흡착할 때 표면 단분자층에서 유기 염료를 흡착하는 것으로 판단된다. 또한, Langmuir 흡착 등온식은 사용된 흡착제의 이론상 최대 흡착량을 계산하는 데 유용하며,31)Table 5의 Langmuir qe 값을 통해 CSB-4는 MO 염료를 최대 1282.60 mg/g까지 흡착하는 것으로 나타났다.
Table 5.
Characteristic parameters of Langmuir and Freundlich models for the adsorption of MO onto CSB-4
| Model | Parameters | MO |
| CSB-4 | ||
| Langmuir isotherm | R2 | 0.97 |
| qe (mg/g) | 1282.60 | |
| k (L/mg) | 0.097 | |
| Freundlich isotherm | R2 | 0.94 |
| n | 0.36 | |
| k (mg/g) | 246.60 |
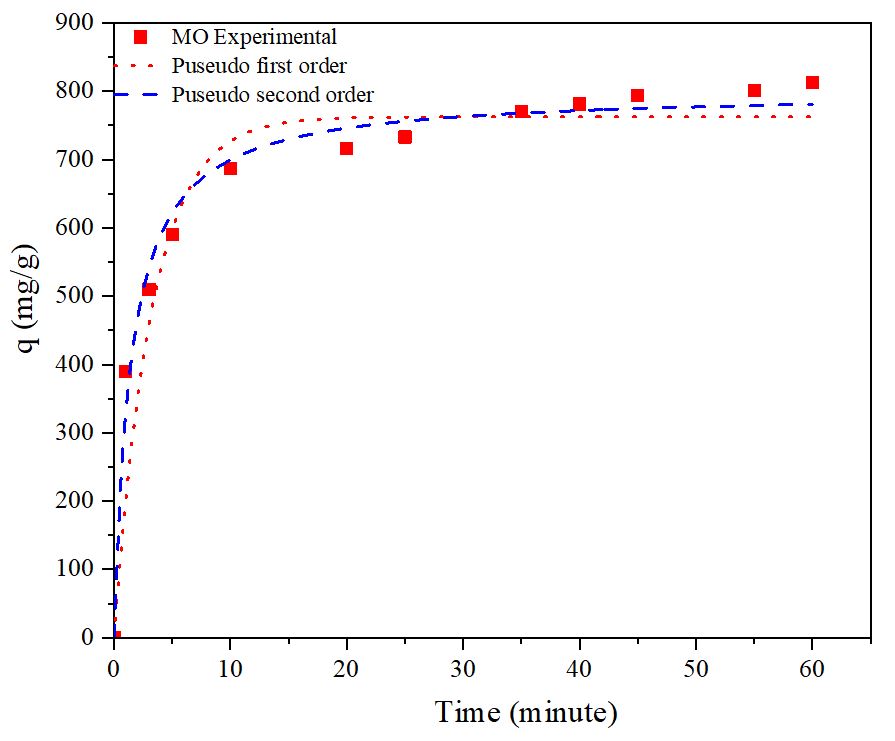
3.1.10 CSB의 흡착 동역학 분석
Fig. 13은 음이온성 염료와 CSB-4의 pseudo-first-order 및 pseudo-second-order kinetic 모델 흡착 동역학 결과를 보여준다. Table 6의 R2 값에 따르면, CSB-4는 pseudo-first-order kinetic 모델보다 pseudo-second-order kinetic 모델에 더 적합한 것으로 나타났다. 따라서 CSB-4의 흡착 메커니즘이 주로 화학적 흡착에 기인한 것으로 판단된다. Table 6의 pseudo-second-order kinetic qe 값을 통해 CSB-4는 MO 염료를 799.37 mg/g까지 흡착하는 것으로 확인되었다.
4. 결 론
본 연구에서 형성된 CSB-4는 키토산과 비교했을 때 페놀성 수산기의 도입으로 인해 이민기의 결합이 확인되었으며, BET 분석을 통해 비표면적이 크게 증가한 것을 확인하였다. 이에 따라 CSB-4는 키토산보다 향상된 항산화 특성과 염료 흡착 능력을 나타낼 것으로 예상되었다. DPPH를 이용한 항산화 특성 실험 결과, CSB-4는 최고 농도에서 RSA 값이 97.58%로, 키토산의 42.54%에 비해 약 2배 이상 증가한 것으로 확인되었다. 또한 CSB-4의 IC50 값이 계산되었으며, 일반적으로 사용되는 상용 항산화제인 BHT와 비교했을 때 CSB-4는 약 3배 이상의 높은 항산화 효과를 나타내었다.32) CSB-4는 양이온성 염료보다는 음이온성 염료에 대해 뛰어난 흡착 성능을 보여주었으며, 최적 흡착 조건은 흡착제 투입량 10 mg, 염료 수용액의 pH 4, 반응 시간 60 분으로 결정되었다. CSB-4의 흡착 등온선 분석은 Langmuir 및 Freundlich 모델을 사용하여 분석되었다. 실험 결과, CSB-4는 Langmuir 모델에 더 적합하여 단분자층의 흡착 메커니즘을 나타내며 최대 흡착량은 1282.60 mg/g으로 확인되었다. CSB-4의 흡착 동역학은 pseudo-first-order 및 pseudo-second-order kinetics 모델을 사용하여 분석되었다. 실험 결과, CSB-4는 pseudo-second-order kinetics 모델에 더 적합하였으며, 이는 CSB-4의 흡착이 주로 화학적 흡착에 의해 이루어짐을 나타낸다. 따라서 본 연구를 통해 키토산에 페놀성 수산기를 도입하여 제조된 CSB-4는 향상된 항산화 특성과 염료 흡착 특성을 갖추고 있음을 확인하였다. 이는 CSB-4가 흡착 및 항산화 소재로서의 잠재력을 지니고 있음을 보여준다.